簡介
DNA拓撲異構酶是存在於細胞核內的一類酶,他們能夠催化DNA鏈的斷裂和結合,從而控制DNA的拓撲狀態,拓撲異構酶參與了超螺旋結構模板的調節。哺乳動物中主要存在兩種拓撲異構酶。DNA拓撲異構酶I通過形成短暫的單鏈裂解-結合循環,催化
DNA複製的拓撲異構狀態的變化;相反,拓撲異構酶II通過引起瞬間雙鏈酶橋的斷裂,然後打通和再封閉,以改變DNA的拓撲狀態。哺乳動物拓撲異構酶II又可以分為αII型和βII型。拓撲異構酶毒素類藥物的抗腫瘤活性與其對酶-DNA可分裂複合物的穩定性相關。這類藥物通過穩定酶-DNA可分裂複合物,有效地將酶轉換成纖維毒素。
臨床使用
這些藥物包括阿黴素(adriamycin)、放線黴素D(actinomycinD)、道諾梅素(daunomycin)、VP-16、VM-26(替尼泊苷teniposide或者表鬼臼毒素(epipodophyllotoxin)。相對來說,無論是臨床,還是處在試驗階段的,作為哺乳動物異構酶II型毒素的藥物較多
雙-和四苯咪唑(Chen等,CancerRes.1993,53,1332-1335;Sun等,J.Med.Chem.1995,38,3638-3644;Kim等,J.Med.Chem.1996,39,992-998),某些白屈菜生物鹼(benzo[c]phenanthridine)和原小檗鹼類生物鹼(protoberberine)與合成的類似體(Makhey等,Med.Chem.Res.1995,5,1-12; Janin等,J.Med.Chem.1975,18,708-713;Makhey等,Bioorg.&Med.Chem.1996,4,781-791),以及bulgerain(Fujii等,J.Biol.Chem.1993,268,),saintopin(Yamashita等,Biochemistry1991,30,5838-5845)和indolocarbazoles(Yamashita等,Biochemistry1992,31,12069-12075)。
其他被確定的拓撲異構酶毒素則包括某些白屈菜生物鹼(benzophenanthridine)和cinnoline化合物(見LaVoie等,美國專利6140328,以及WO01/32631)。儘管這些化合物大有用途,但是由於其較低的溶解性使得他們的套用受到限制。
2006年1月下旬,美國專利局連續授予了美國新澤西大學關於以拓撲異構酶(topoisomerase)為作用靶位的氨基和硝基替代類藥物的合成及套用的四個專利。
分類
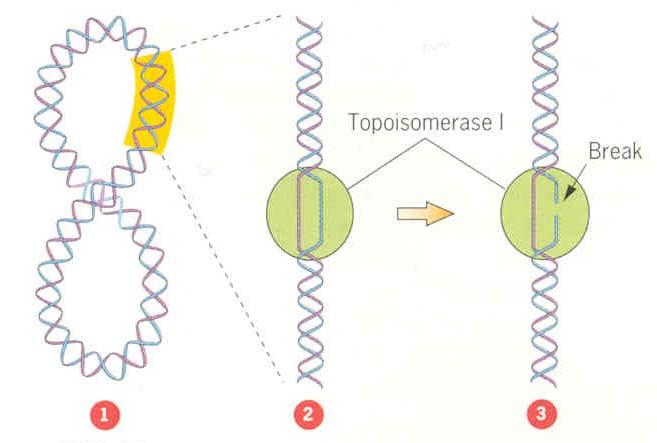
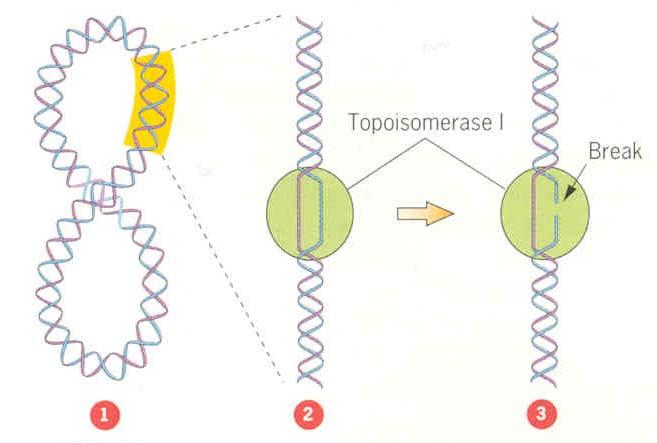
可分為兩類一類叫拓撲異構酶I,一類叫拓撲異構酶II。拓撲異構酶I催化DNA鏈的斷裂和重新連線,每次只作用於一條鏈,即催化瞬時的單鏈的斷裂和連線,它們不需要能量輔因子如ATP或NAD。
E.coliDNA拓撲異構酶I又稱ω蛋白,大白鼠肝DNA拓撲異構酶I又稱切刻-封閉酶(nicking-closing enzyme )。拓撲異構酶II能同時斷裂並連線雙股DNA鏈.它們通常需要能量輔因子ATP。在拓撲異構酶II中又可以分為兩個亞類:一個亞類是
DNA旋轉酶(DNA gyrase ),其主要功能為引入負超螺旋,在DNA複製中起十分重要的作用。迄今為止,只有在原核生物中才發現DNA旋轉酶.另一個亞類是轉變
超螺旋DNA(包括正超螺旋和負超螺旋)成為沒有超螺旋的鬆弛形式(relaxed form )。這一反應雖然是熱力學上有利的方向,但不知道為什麼它們仍然像DNA旋轉酶一樣需要ATP,這可能與恢復酶的構象有關。這一類酶在原核生物和真核生物中都有發現。
第一類
DNA拓撲異構酶能催化的反應很多,這裡只能作簡單敘述。DNA拓撲異構酶I對單鏈DNA的親和力要比雙鏈高得多,這正是它識別
負超螺旋DNA的分子基礎,因為負超螺旋DNA常常會有一定程度的單鏈區。負超螺旋越高,DNA拓撲異構酶I作用越快。現已知道,生物體內負超螺旋穩定在5%左右,低了不行,高了也不行。生物體通過拓撲異構酶1和II的相反作用而使負超螺旋達到一個穩定狀態。現已發現,編碼E.coli拓撲異構酶I的基因topA發生突變,則會引起旋轉酶基因的代償性突變;否則,負超螺旋增高,細胞生活能力降低。拓撲異構酶I作用的鹼基序列特異性不高,但切點一定在C的下遊方向4個鹼基(包括C本身)的位置。在將DNA單鏈切斷後,拓撲異構酶I連線於切口的5端,並貯藏了水解磷酸二脂鍵的能量用以連線切口,因而拓撲異構酶I的作用不需能量供應。此外.拓撲異構酶I還能促進兩個單鏈環的復性,其作用是解除復性過程所產生的鏈環數的負值壓力,以使復性過程進行到底。如果在一個單鏈環上一個部位切斷,而使另一部位繞過切口.則可產生
三葉結結構分子 (trefoil knot)。如果有兩個雙鏈環,其中一個有一個切刻,拓撲異構酶1則可以將切刻對面的一條鏈切斷,伎完整的雙鏈環套進去,再連線起來而成為環連體分子(catenane),以上這三種反應示於右圖。拓撲異構酶I還能催化其他反應,這將在複製和重組的機制中再講述。
第二類
大腸桿菌的拓撲異構酶II(gyrase)除了引入負超螺旋以外.還具有形成或拆開雙鏈DNA環連體和成結分子的能力。II類拓撲異構酶沒有鹼基序列特異性,它們可以和任何相交的兩對雙鏈DNA結合。DNA旋轉酶有兩個α亞基和兩個β亞基。α亞基約105KDa,為gyrA基因所編碼,具有磷酸二脂酶活性,可為萘啶酮酸(nalidixic acid )所抑制。A亞基約95KD,為graB基因所編碼,具有ATP酶活性,可為新生黴素(novobiocin )所抑制。這兩種藥物均可抑制野生型大腸桿菌的DNA複製。可見DNA旋轉酶為E.coli的複製所不可缺少的。在切斷一條DNA雙鏈後,兩個a亞基各結合於切口的一個5'端,並貯藏了水解
磷酸二酯鍵而獲得的能量,由於該酶的整體性,因而DNA鏈的四個斷頭並無任意旋轉的可能性。由於酶的別構效應,使完整的雙鏈穿過切口,然後再重新形成磷酸二酯鍵。β亞基的功能在於水解ATP以使酶分子恢復原來的構象,以便進行下一輪反應。這一點可以用ATP的同系物β,γ-亞氨基ATP代替ATP而得到證實。因為這一同系物不能被DNA旋轉酶所水解,但它確能促進第一輪拓撲異構反應,使負超螺旋增加,而妨礙以後進一步的拓撲異構反應。
化學反應
DNA拓撲異構酶催化反應
很多,其反應本質是先切斷DNA的磷酸二脂鍵,改變DNA的鏈環數之後再連線之,兼具DNA內切酶和
DNA連線酶的功能.然而它們並不能連線事先已經存在的斷裂DNA,也就是說,其斷裂反應與連線反應是相互耦聯的。拓撲異構酶(包括Ⅰ型和II型)都可以用符號轉化模型進行解釋(下圖左中)
除了DNA拓撲異構酶可以產生異構變化以外,很多能夠嵌入相鄰
鹼基之間影響鹼基堆集作用的試劑,特別是片狀的染料分子.也能改變DNA的拓撲狀態,最明顯的例子就是
溴化乙錠(ethidium bromide)。例如以SV40的CCC分子與溴化乙錠的結合試驗為例,當沒有染料時,此DNA為
負超螺旋,具有較高的
沉降常數(21S);當加入染料分子與
核苷酸之比為0.05時,沉降數降至l6S,此時DNA為沒有超螺旋的鬆弛形式;當染料分子和核苷酸的比值增加到0.09時,沉降常數又上升到大約21S,此時DNA分子為
正超螺旋。這種關係如上圖右所示,不過要注意的是,
溴化乙錠並沒有改變Lk值,只不過是由溴化乙錠分子的嵌入,增加了局部
DNA二級結構的緊纏狀態。因而,隨著嵌入染料分子數的增多,起初表現為負超螺旋的減少與消失,隨後便是正超螺旋的增加。這與
單鏈DNA結合蛋白促進負超螺旋轉變為泡狀結構的情況是類似的。
DNA拓撲異構酶(DNA topoisomerase)
為催化DNA
拓撲學異構體相互轉變的酶之總稱。催化DNA鏈斷開和結合的偶聯反應,為了分析體外反應機制,用環狀DNA為底物。在閉環狀雙鏈DNA的拓撲學轉變中,要暫時的將DNA的一個鏈或兩個鏈切斷,根據
異構體化的方式而分為二個型。切斷一個鏈而改變拓撲結構的稱為Ⅰ型拓撲異構酶(top- oisomeraseⅠ),通過切斷二個鏈來進行的稱為Ⅱ型拓撲異構酶(topoisomeraseⅡ)。屬於Ⅰ型的拓撲異構酶,有大腸桿菌的ω蛋白(ω-protein,由分子量11萬的單個多肽鏈所成)及各種真核細胞中存在的切斷-
結合酶(nicking-closing enzyme,分子量約6萬5千—7萬的及分子量約10萬的)。Ⅱ型拓撲異構酶,有存在於細菌中的DNA促旋酶、
噬菌體T4的拓撲異構酶Ⅱ以及真核細胞中依賴ATP的拓撲異構酶Ⅱ等。另外,噬菌體λ的irt
基因產物和噬菌體φX174的基因A的產物等也具有切斷—結合酶的活性,可認為是拓撲異構酶之一種。Ⅰ型拓撲異構酶不需要ATP的能量而催化異構體化,作為反應的中間產物,在
原核生物來說是游離型的5′-OH末端扣3′-磷酸末端與酶形成
共價鍵,而真核生物是3′-OH末端5′-磷酸末端與酶形成共價鍵。此酯鍵中所貯存的能量,可能在切斷端的再結合上起著作用。Ⅰ型拓撲異構化
酶催化的反應有下列各種:使超螺旋DNA在每一切斷—結合反應中,使L數(參見
DNA拓撲學異構體)發生一種變化,即鬆弛(relaxation)。將互補的單鏈環狀DNA轉變成具有
螺旋結構的雙鏈環狀DNA,使單鏈DNA打結(topological knot)或解結。另外在二個環狀雙鏈DNA一個分子的一個鏈切斷時,形成鏈環狀
二聚體的分子(ca-tenane)。在Ⅱ型拓撲異構酶中,DNA促旋酶可單獨催化閉環狀DNA產生
超螺旋,這是獨特的。其它二個型的酶,除可使超螺旋鬆弛也需要ATP的能量外,還可催化促旋酶的
催化反應。真核細胞的拓撲異構酶Ⅰ,參與
核小體的形成,細菌的ω蛋白參與轉錄和某種
轉位子的插入。促旋酶和T4拓撲異構酶Ⅱ參與DNA的複製和轉錄過程。
DNA 拓撲異構酶 I (DNA Topoisomerase I)催化4種反應:
①超螺旋的鬆弛;
②繩結(knot)的形成;
④環狀雙鏈分子的連線。本酶由於來源於小牛胸腺,與來源於
原核生物的酶性質不同,即使在Mg2+不存在的條件下也顯示活性。而且,原核生物由來的DNA Topoisomerase I 只作用負鏈的
超螺旋分子,而本酶則能使正負兩方的超螺旋分子均形成鬆散型。
用途
DNA的結構轉換和解析
Ⅱ型拓撲異構酶
Ⅱ型拓撲異構酶巧妙地執行了打開
DNA雙螺旋的過程。它將DNA的一個雙螺旋結構切開,並讓另一個螺旋從缺口處穿過,在此之後一個雙螺旋便被打開。這裡顯示的圖片是由兩個蛋白構建的:這個編號為1bgw的蛋白具有拓撲異構酶的下半部分結構,另外一個編號為1eil的蛋白來自於一個旋轉酶的
結構域,它與拓撲異構酶的上部很相似。拓撲異構酶具有很高的
催化活性,它具有一些類似於“門”的結構,控制著DNA進入到其上面的兩個裂口內。 此處用紅色顯示的兩個酪氨酸與DNA鏈相結合併形成
共價鍵,並且這種緊密的結合方式直到DNA重新恢復為止。
作用
是使超級螺旋鬆弛。所謂超級螺旋是DNA中張力積聚的形式。拓撲異構酶抑制成分是重要抗腫瘤藥物,被認為通過穩定拓撲異構酶與DNA之間所形成的一種共價複合物來發揮作用,後者又為DNA複製機制設定了一障礙。科學家對以拓撲異構酶為作用目標的藥物的藥效起源仍不是很了解。本期封面圖片所示為由於該藥物的作用而造成的正向DNA超級螺旋的積累。DNA的這種超級纏繞會妨礙一種
DNA聚合酶的前行,並且在阻止或破壞
複製叉,從而導致細胞死亡過程中也可能扮演一個角色。
新發現
DNA螺旋與拓撲異構酶相互作用的新發現
一個荷蘭人領導的國際性研究組在分子水平上破解了自然釋放DNA中積累起來的扭曲張力的機制。來自Delft理工大學、Ecole Normale Superieure和Sloan-Kettering研究所的研究人員將他們的發現公布在3月31日的《自然》雜誌上,並成為這一期雜誌的封面。
IB型拓撲異構酶能夠釋放DNA鏈中積累的扭力。研究過程中,研究人員能夠在分子水平上跟蹤一個單個的拓撲異構酶分子一段時間內在單個DNA分子上的活動。拓撲異構酶能夠夾著DNA、切開兩個DNA鏈中的一個並使DNA在與
粘性末端重新結合在一起前變得舒展。在靈敏的檢測儀器的幫助下,研究人員能夠測量不同參數,如在酶空腔中的旋轉的DNA的摩擦力。這項研究對DNA和這種酶之間的相互作用有了新的了解。
DNA的兩個單鏈紐在一起並形成雙螺旋結構,而雙鏈的鹼基對序列儲存著
遺傳信息。在
細胞分裂過程中,遺傳物質被複製並且負責複製的酶必須能夠將這些鹼基序列轉錄。但是要實現這個過程就必須將需要轉錄的DNA部分變直。這種纏繞和舒展共存的DNA分子中產生了扭力,其扭力的大小隨著細胞分裂過程的發展而增加。這種力能夠延遲細胞分裂過程並且在一些情況下甚至終止分裂,而IB型拓撲異構酶則能減少這些扭力。
這種酶釋放DNA扭力的步驟如下:拓撲異構酶先像夾子一樣夾住雙鏈DNA,然後瞬時穿過兩條DNA鏈中的其中一條。DNA分子中積累的這種扭力然後在完整鏈附近被消磨掉。在旋轉之後,這種酶再次緊緊抓住旋轉的DNA並將斷裂的鏈重新粘連起來。研究人員能夠測定出這種拓撲異構酶在剪下和粘連過程之間卸掉的
超螺旋的確切數目。
IB型拓撲異構酶工作的精確機制還對癌症研究有重要意義。能夠抑制IB拓撲異構酶功能的藥物已在臨床上有所使用,但它們的使用可能在獲得這些發現後得到改善。