微流式細胞儀:以微毛細管技術為基礎的新一代高性能流式細胞儀。自1998年微毛細管技術用於流式細胞檢測的技術在美國獲得專利以來,微流式技術以微樣本量、微操作量、微學習量、微負擔以及微體積,為腫瘤學、免疫學、慢性疾病研究以及新藥研發和轉化醫學等領域提供檢測方案。
基本介紹
- 中文名:微流式細胞儀
- 基礎:微毛細管技術
- 用途:腫瘤學、免疫學、慢性疾病研究
- 組成:四部分
基本結構,組成,微流式特色的液流系統,雷射和光學系統,光電檢測器件,軟體系統,微流式套用,微流式檢測方案,
基本結構
組成
微流式細胞分析儀主要由四部分組成:以微毛細管專利技術為基礎的液流系統;雷射和光學系統;光電檢測器件;以及軟體系統。
微流式特色的液流系統
微毛細管技術:樣品上樣時,由微毛細管與樣品液體接觸的橫截面中心形成的負壓區,形成單細胞流上行。注射泵提供穩定精確的上樣流與上樣體積。由微毛細管和注射泵協同作用形成的單細胞流更加精確與穩定。運行8小時只產生不到50ml的廢液;允許檢測樣本最小上樣量僅為1000個細胞;同時無鞘液系統的液流系統成固定狀態,儀器操作簡單,縮短學習時間,從而提高研究效率。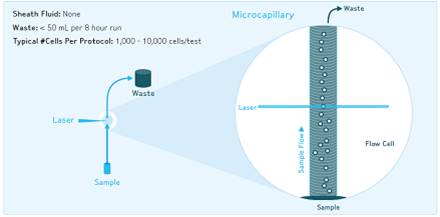 微流式工作原理
微流式工作原理
 微流式工作原理
微流式工作原理雷射和光學系統
微流式通過雷射照射對細胞上不同的特性進行檢測。雷射器的選擇對細胞分析檢測尤為重要。全固態雷射器(DPL)具有體積小、重量輕、效率高、性能穩定、可靠性好、壽命長、光束質量高等優點。由於其單位輸出的熱負荷降低,可獲取更高的功率,更長的系統壽命和可靠性。除了雷射器材料的選擇外,還可根據激發波長對雷射器進行選擇。488nm是最通用的雷射器波長,可以激發包括FITC, PE, PE-Cy5.5, PE-Cy7,PI, CFSC等多種螢光素。640nm雷射器是紅色雷射器,通用螢光素包括了APC, AlexaFluor647, APC-Cy7等螢光素,多用於免疫檢測。
光學系統中的多種濾片的組合設計為提高螢光信號的信噪比提供了保障。帶通濾片(band-Pass filter)是一個允許特定頻段的波通過,同時禁止其他頻段的濾光光片,如: 690/50表示只有665-715nm範圍內的光才能通過,任何小於665nm或大於715nm的光不被透過。因此,確保了對特異性螢光的檢測,並提高信噪比。
光電檢測器件
經雷射激發的特異性螢光信號,必須通過光電轉換器才能將光信號轉換為電子信號,並被計算機處理。光電倍增管(PMT)是被廣泛套用於螢光信號檢測器件。PMT可將微弱螢光信號通過光電效應轉變成電信號並利用二次發射電極轉為電子培增的電真空器件。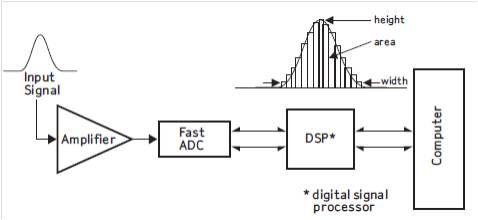 光電檢測器件
光電檢測器件
 光電檢測器件
光電檢測器件由PMT檢測器輸出的脈衝信號經快速模數轉換器(FAST ADC)處理後輸入到計算機內。Fast ADC比傳統A/D處理處理速度更快,反應更靈敏。
軟體系統
軟體系統是用戶直接接觸的界面。軟體系統通常控制了儀器的啟動、維護、樣本的採集和數據分析功能。軟體系統的智慧型化程度決定了儀器的可操作程度。目前被普遍接受的軟體系統通常包括了模組化的維護程式、智慧型化套用模組以及用戶可調的開放模組。智慧型化套用模組越齊全,用戶的學習周期則越短,越能儘早上手作業系統。如多色螢光檢測時的多色螢光補償通常限制了入門級用戶操作儀器的難點。最新的軟體系統支持自動螢光補償,以準確、標準的設定提高儀器的可操作度,擺脫對經驗的依賴並確保數據的準確性。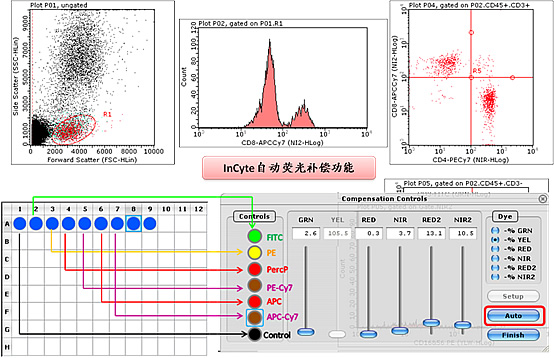 軟體界面
軟體界面
 軟體界面
軟體界面由此可見,軟體系統的數據分析力是判斷儀器總體表現重要環節。提供數據分析策略的軟體,往往能提供更直觀的分析結果,整合縱向數據進行比較,結合最先進的統計模組,並為實現自動螢光補償提供策略。
微流式套用
哈佛大學醫學院的Crawford博士提到:“微毛細管技術被引入流式細胞儀徹底改變了我們對實驗動物模型建立的思路。以前,當我們需要臨床前藥物測試時,我們不得不在每一個時間點殺死一隻小鼠以獲得足夠的全血樣本量。而現在,每次實驗只需要一滴血,因此就可以將同一隻小鼠保留下來,檢測不同時間點的變化。從而使我們獲得了以前從來沒有的生物學信息:即在同一隻小鼠上監測疾病不同進程下的免疫功能變化。”
休斯頓大學運動醫學教授McFarlin博士在研究性論文中提到:“目前為止,很少有研究者對同一隻小鼠進行縱向的疾病進程跟蹤研究,這是因為傳統的流式細胞儀無法支持超微樣本量的檢測。微毛細管細胞分析儀使得利用單核細胞對慢性免疫疾病發展進行縱向跟蹤的實驗設計成為現實。”
以微毛細管為基礎的微流式對上樣樣品量的需求降低至傳統技術的十分之一。這也就為珍稀來源樣本的研究、新藥篩選、腫瘤研究、幹細胞研究以及系統性疾病的研究提供了有力的檢測工具,開創了實驗動物模型檢測的新思路。
微流式檢測方案
以較為常見的T淋巴細胞亞群檢測為例
T淋巴細胞亞群在許多臨床疾病中可發生異常改變,特別是免疫功能受損的病人。測定T淋巴細胞亞群變化對了解疾病的發病機制、指導臨床治療、控制疾病的發生髮展均有重要意義。根據不同的表面標誌物可以對T細胞進行分群,其中CD3+/CD4+為輔助性T細胞,CD3+/CD8+為殺傷性T細胞。
使用流式細胞儀和螢光標記抗體,可以對人全血標本中T細胞CD3/CD4進行分群和絕對計數。
實驗流程: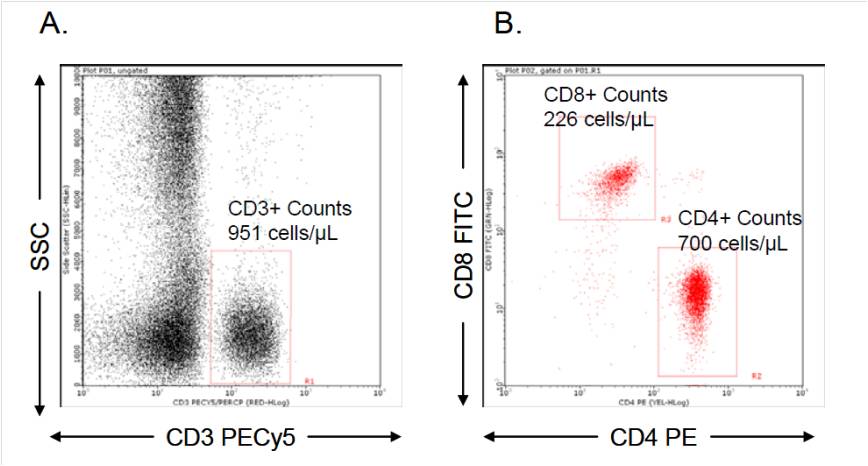 微流式實驗結果
微流式實驗結果
 微流式實驗結果
微流式實驗結果1. 靜脈採血,肝素或EDTA抗凝;
2. 在試管中加入10ul CD8-FITC/CD4-PE/CD3-PECY5 抗體;
3. 向試管內加入10ul抗凝全血(約1×10的5次方個細胞)混勻試劑和全血;
4. 室溫(18-25℃)避光孵育20min;
5. 加入180ul 1X 紅細胞裂解液;
6. 室溫(18-25℃)避光孵育15min;
7. 使用微流式細胞分析儀獲取結果
