如果一電極的電極反應是可逆的,通過電極的電流非常小,電極反應是在平衡電位下進行的,這種電極稱為可逆電極。可逆電極的本質特徵主要有兩個,即單一電極和反應可逆。所謂單一電極即電極上只能發生一種電化學反應,能同時發生多個反應的多重電極不可能構成可逆電極。其次,可逆電極的反應必須可逆,即充電和放電時發生同一反應只是方向相反。
基本介紹
- 中文名:可逆電極
- 外文名:Reversible electrode
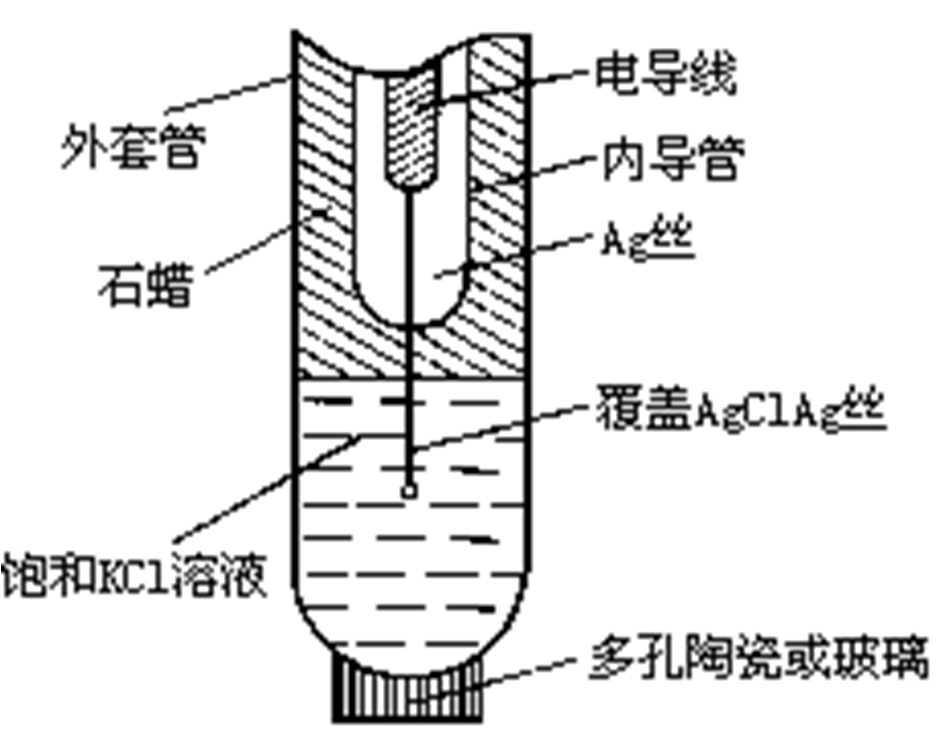
- 例子:Ag|AgNO3
- 學科:冶金工程
- 領域:冶煉
- 特徵:單一電極和反應可逆
如果一電極的電極反應是可逆的,通過電極的電流非常小,電極反應是在平衡電位下進行的,這種電極稱為可逆電極。可逆電極的本質特徵主要有兩個,即單一電極和反應可逆。所謂單一電極即電極上只能發生一種電化學反應,能同時發生多個反應的多重電極不可能構成可逆電極。其次,可逆電極的反應必須可逆,即充電和放電時發生同一反應只是方向相反。
如果一電極的電極反應是可逆的,通過電極的電流非常小,電極反應是在平衡電位下進行的,這種電極稱為可逆電極。可逆電極的本質特徵主要有兩個,即單一電極和反應可逆。...
如果電極界面上存在著單獨一種氧化還原對的快速電子交換,即存在著交換電流很大的(見遷越超電勢)單一電極反應,這種電極能很快建立電化學平衡,稱為可逆電極。可逆電極...
reference electrode 測量各種電極電勢時作為參照比較的電極。將被測定的電極與精確已知電極電勢數值的參比電極構成電池,測定電池電動勢數值,就可計算出被測定電極的...
可逆電池的穩定電位稱為可逆電池電位。可逆電池中的“可逆”是指電池充電時的電極反應是放電時電極反應的逆反應,具有該性質的電池稱之為可逆電池。當電極反應穩定時...
將電解池作為可逆電池計算而得的電動勢。過電位為實際進行電解時所用的分解電壓和可逆電壓(將電解池作為可逆電池計算而得的電動勢)的差值。...
準可逆電極反應quasi-reversible ek}trocie reaction指電荷遷越電極界面發生電子得失這一步驟較易進行的電極反應,即遷越步驟(或稱活化步驟)速率與擴散步驟速率相差並...
在不可逆條件下,當有電流通過電極時,發生的是不可逆的電極反應,此時的電極電勢與可逆電極電勢會有所不同。電極在有電流通過時所表現的電極電勢與可逆電極電勢產生...
標準氫電極(Standard Hydrogen Electrode,SHE):鉑電極在氫離子活度為1mol/L的理想溶液中所構成的電極(當前零電位的標準)。可逆氫電極(Reversible Hydrogen Electrode,...
標準電極電勢表,是指半反應按電極電勢由低到高排序,可十分簡明地判斷氧化還原反應的方向。標準電極電勢是可逆電極在標準狀態及平衡態時的電勢,也就是標準態時的...
標準電極電勢是可逆電極在標準狀態及平衡態時的電勢,也是標準態時的電極電勢。指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。...
氫醌電極,也稱為醌氫醌電極,一種可逆氧化還原電極,電極式為C6H4O2+2H+ →C6H4(OH)2+2e-。氫醌在水溶液中溶解度小,易建立平衡,溶於水後按C6H4O2˙C6H4(OH)...
電極-電解質系統是化學能與電能互相轉化的電化學電池裝置,它可以分為原電池和電解池兩大類。原電池能自發地將化學能轉化為電能;電解池則需要消耗外部電源提供電能,...
一種氣體電極,如果以空氣代替氧,即為空氣電極。電極反應為2H2O+O2+4e-=4OH-,但此反應不易達平衡,故可逆氧電極難於實現。氧電極在電解水製取氧氣,研製氫/氧...
電極反應是指在電極上發生的失去或獲得電子的電化學反應。失去電子的反應稱為氧化反應或陽極反應,發生該反應的電極稱為陽極;獲得電子的反應稱為還原反應或陰極反應,...
書中將電極反應原理、套用技術與實驗方法有機地融為一體,化繁為簡,講述深入淺...1.6 可逆與不可逆電極反應比較 1.7 吸附 1.7.1 研究吸附的方法 1.7....
一個電極/溶液界面發生兩個或兩個以上的電極反應時,平衡電位較正的電極將發生淨的還原反應,平衡電位較負的電極將發生淨的氧化反應,兩電極構成一短路原電池。界面...
