歷史沿革
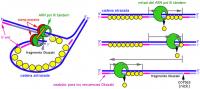
DNA複製過程中,2條新生鏈都只能從5'端向3'端延伸,前導鏈連續合成,滯後鏈分段合成,這些分段合成的新生DNA片段稱岡崎片段,細菌岡崎片段長度1000-2000核苷酸殘基,真核生物岡崎片段長度100-200核苷酸殘基.在連續合成的前導鏈中,U-糖苷酶和AP內切酶也會在錯配鹼基U處切斷前導鏈,任何一種
DNA聚合酶合成方向都是從5'向3'方向延伸,而DNA模板鏈是反向平行的雙鏈,這樣在一條鏈上,DNA合成方向和複製移動方向相同(前導鏈),而在另一條模板上卻是相反的(後滯鏈)。那么在
複製叉中新鏈是如何合成的呢?1968年岡崎(Okazaki)及其同事進行了一系列實驗,回答了這一問題。岡崎片段名稱就是源自最早發現團隊的領導者,也就是岡崎令治與岡崎恆子(一對夫妻)的姓氏。其團隊是在研究大腸桿菌中的
噬菌體DNA複製情形時發現此現象。
一組短的DNA片段,是在DNA複製的起始階段產生的,隨後又被
連線酶連線形成較長的片段。在大腸桿菌生長期間,將細胞短時間地暴露在
氚標記的
胸腺嘧啶中,就可證明岡崎片段的存在。岡崎片段的發現為DNA複製的科恩伯格機理提供了依據。
試驗檢測
兩組實驗,一組是脈衝標記實驗(pulse-labeling experiment)。以
E.coli為材料,在培養時,
培養基中加入
同位素[3H]標記的dTTP前體(Thymidine),經30秒後,DNA剛開始複製,分離DNA,然後在鹼中沉澱,變性,讓新合成的單鏈和
模板鏈分開,再用CsCl
密度梯度離心,以
沉降的快慢來確定片段的大小,再檢測放射標記,結果表明被3H標記的片段,也就是新合成的片段,沉澱係數為20S左右,即都是長1000~2000Nt的DNA片段,而親本鏈要比它大20~50倍;第二組實驗是脈衝追逐實驗。目的是檢測早期合成的DNA片段以後的命運又是如何的?是依然如舊的短片段,還是連線成了長片段。這個實驗是先進行標記培養30秒,以後除去同位素繼續培養幾分鐘,再分離DNA在鹼中沉澱,檢測結果。先合成的(帶標記)的DNA不再是短片段,而和總DNA的情況相似,沉澱係數為70S~120S較長的片段,這意味著剛開始合成的片段都是短片段,以後再連線成長片段,人們就把最初合成的短片段稱為岡崎片段(Okazaki fragment)。由於這個實驗的結果使得人們普遍認為:無論是
前導鏈還是後滯鏈都是先合成小片段,然後在連成大片段,稱為“
不連續複製“(discontinuous replication)。然而由模型預測應該只有一半放射標記存在於小片段中,但實驗的結果卻全部是小片段DNA,為什麼從前導鏈模板的3′-OH端延伸會不連續合成呢?人們在思考這個問題。1978年Olivera提出了半不連續(semidiscontinuous)複製模型,也就是說前導鏈上的合成是連續的,只有後滯鏈上的合成才是半連續的。已經弄清原來是由於細胞內都存在有dTTP和dUTP,而DNApolⅢ卻並不能區分它們,因此也會將dUTP加入到DNA中,形成A·U對。那么在DNA中為什麼沒有U的存在呢?這是因為E.coli細胞里有雙重“保險”,防止了U的“混入”。第一道關是細胞里的dUTPase,它能使dUTP變成dUMP,dUMP是不能作為DNA合成的底物,這樣它就不再能加入DNA中。但總還有些漏網之“魚”,它們還是逃過此關,混入DNA中,這就靠第二道關來清除“異己”,這道關的主角是尿嘧啶N-糖苷酶(uracilN-glycosylase),它可以切斷混合
尿苷的糖苷鍵,形成無Pu和Py位點(apurinicora pyrimidinic,AP),再由AP內切酶在AP位點切出一個缺口,進一步進行
切除修復。在細胞內尿嘧啶N-糖苷酶作用較快,而AP酶作用較慢,在新鏈合成之初約1200bp就有可能摻進一個U,但很快就被尿嘧啶N-糖苷酶切斷糖苷鍵,在AP酶未作用前在脈衝標記實驗中就提取了,用NaOH沉澱時,AP位點十分易斷裂,所以
前導鏈也成了小片段。以下實驗證實了這個解釋:
 岡崎片段
岡崎片段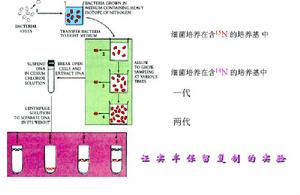 岡崎片段
岡崎片段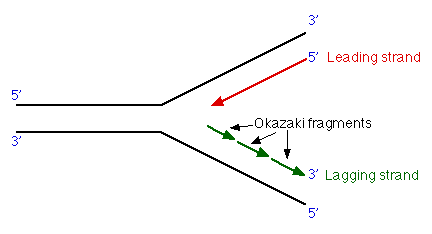 岡崎片段
岡崎片段(1)在dut-突變體(dUTPase缺失)中岡崎片段比在dut+中為短。這是因為U摻入機會增加;(2)在ung-(尿嘧啶N-
糖苷酶缺失)突變體中,新合成的DNA約有一半由片段組成。(3)因為尿嘧啶N-糖苷酶缺失,不會切除U的糖苷鏈,也就不會出現AP位點,所以鹼沉澱時不易斷裂,從而保持了半不連續的原貌。
在dut-,ung-雙突變體中,結果和實驗(2)相同,更進一步證實了此推測。真核岡崎片段的成熟機制比較複雜,由Polδ、RNaseHI、FEN1、Dna2和
DNA連線酶等多種蛋白質協同通過兩種機制加工完成。Polδ的3′→5′
核酸外切酶活性能替代FEN1,在岡崎片段成熟中通過阻止過量的DNA鏈替代合成,保證產生能被DNA連線酶連線的具有單一切口兩個DNA片段,有利於保持基因組的穩定性。
DNA雙鏈
在DNA雙鏈進行
半保留複製時,在複製點附近新合成的與親代DNA鏈互補的DNA片段。是岡崎令治等(1966)首先發現的。在大腸桿菌約為1千-2千
核苷酸的長度。DNA聚合酶只使脫氧核苷酸在5′→3′的方向重合。而半保留複製在5′→3′方向重合的同時,在3′→5′方向的重合也是不可缺少的。此矛盾由岡崎片段的發現,以及在其基礎上的
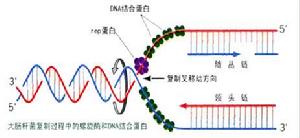
不連續複製模式而解釋了。在複製點,如圖所示,首先由DNA聚合酶的作用,在5′→3′方向與親代DNA分子雙方的鏈互補,由
脫氧核苷酸配對重合,形成短的DNA片段,它們再由DNA連線酶的作用而結合起來形成長的DNA分子,並逐漸複製成為DNA雙鏈。
 岡崎片段
岡崎片段遺傳信息
DNA是遺傳信息的載體,故親代DNA必須以自身分子為模板準確的複製成兩個拷貝,並分配到兩個子細胞中去,完成其遺傳信息載體的使命。而DNA的雙鏈結構對於維持這類
遺傳物質的穩定性和複製的準確性都是極為重要的。
 岡崎片段
岡崎片段DNA的半保留複製
Waston和Click在提出
DNA雙螺旋結構模型時曾就DNA複製過程進行過研究,他們推測,DNA在複製過程中鹼基間的
氫鍵首先斷裂,雙螺旋
解旋分開,每條鏈分別作
模板合成新鏈,每個
子代DNA的一條鏈來自親代,另一條則是新合成的,故稱之為
半保留式複製(semiconservativereplication)。
1958年Meselson和Stahl進行了如圖8-3-5的實驗證明了DNA分子是以半保留方式進行自我複製的。
DNA複製的起始,方向和速度
DNA在複製時,雙鏈
DNA解旋成兩股分別進行。其複製過程的複製起點呈現叉子的形式,故稱
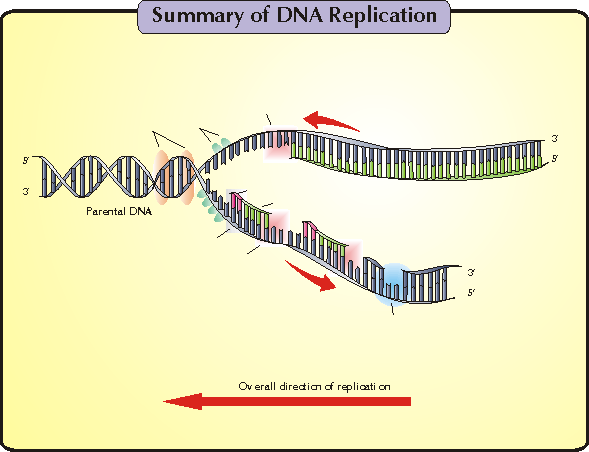
複製叉。以複製叉向前移動的方向為標準,一條
模板鏈為3’—〉5’走向,在其上DNA能以5’—〉3’方向連續合成,稱為
前導鏈(leadingstrand);另一條模板鏈為5’—〉3’走向,在其上DNA也是5’—〉3’方向合成,但與複製叉移動的方向正好相反,故隨著複製叉的移動形成許多不連續的岡崎片段,最後在連成一條完整的DNA鏈,該鏈稱為
後隨鏈(laggingstrand)。實驗證明DNA的複製是由一個固定的起始點開始的。一般把生物體的單個複製單位稱為
複製子。一個複製子只含一個複製起點。一般說,細菌,病毒及
線粒體DNA分子均作為單個複製子完成其複製,真核生物基因組可以同時在多個複製起點上進行
雙向複製,即它們的基因組包括多個複製子。多方面的實驗結果表明,大多數生物內DNA的複製都是從固定的起始點以雙向等速方式進行的。
複製叉以DNA分子上某一特定順序為起始點,向兩個方向等速生長前進。
DNA複製過程
DNA在複製時,其雙鏈首先解開,形成
複製叉,而複製叉的形成則是由多種蛋白質及酶參與的較複雜的複製過程
(1)
單鏈DNA結合蛋白(single—strandedDNAbindingprotein,ssbDNA蛋白)ssbDNA蛋白是較牢固的結合在單鏈DNA上的蛋白質。
原核生物ssbDNA蛋白與DNA結合時表現出協同效應:若第1個ssbDNA蛋白結合到DNA上去能力為1,第2個的結合能力可高達103;真核生物細胞中的ssbDNA蛋白與單鏈DNA結合時則不表現上述效應。ssbDNA蛋白的作用是保證
解旋酶解開的單鏈在複製完成前能保持單鏈結構,它以
四聚體的形式存在於
複製叉處,待單鏈複製後才脫下來,重新循環。所以,ssbDNA蛋白只保持單鏈的存在,不起
解旋作用。
DNA解鏈酶能通過水解ATP獲得能量以解開雙鏈DNA。這種
解鏈酶分解ATP的活性依賴於單鏈DNA的存在。如果雙鏈DNA中有單鏈末端或切口,則DNA解鏈酶可以首先結合在這一部分,然後逐步向雙鏈方向移動。複製時,大部分
DNA解旋酶可沿滯後模板的5’—〉3’方向並隨著複製叉的前進而移動,只有個別解旋酶(Rep蛋白)是沿著3’—〉5’方向移動的。故推測Rep蛋白和特定DNA解鏈酶是分別在DNA的兩條
母鏈上協同作用以解開雙鏈DNA。
(3)DNA解鏈過程
DNA在複製前不僅是雙螺旋而且處於
超螺旋狀態,而超螺旋狀態的存在是解鏈前的必須結構狀態,參與解鏈的除
解鏈酶外還有一些特定蛋白質,如大腸桿菌中的Dna蛋白等。一旦DNA局部雙鏈解開,就必須有ssbDNA蛋白以穩定解開的單鏈,保證此局部不會恢復成雙鏈。兩條單鏈DNA複製的引發過程有所差異,但是不論是
前導鏈還是
後隨鏈,都需要一段RNA引物用於開始子鏈DNA的合成。因此前導鏈與後隨鏈的差別在於前者從複製起始點開始按5’—3’持續的合成下去,不形成岡崎片段,後者則隨著
複製叉的出現,不斷合成長約2—3kb的岡崎片段。
因DNA的兩條鏈是反向平行的,故在複製叉附近解開的DNA鏈,一條是5’—〉3’方向,另一條是3’—〉5’方向,兩個模板
極性不同。所有已知DNA聚合酶合成方向均是5’—〉3’方向,不是3’—〉5’方向,因而無法解釋DNA的兩條鏈同時進行複製的問題。為解釋DNA兩條鏈各自
模板合成子鏈等速複製現象,日本學者岡崎(Okazaki)等人提出了DNA的半
連續複製(semidiscontinuousreplication)模型。1968年岡崎用3H脫氧胸苷短時間標記大腸桿菌,提取DNA,變性後用
超離心方法得到了許多3H標記的,被後人稱作岡崎片段的DNA。延長標記時間後,岡崎片段可轉變為成熟DNA鏈,因此這些片段必然是複製過程中的中間產物。另一個實驗也證明DNA複製過程中首先合成較小的片段,即用DNA
連線酶溫度敏感突變株進行試驗,在連線酶不起作用的溫度下,便有大量小DNA片段積累,表明DNA複製過程中至少有一條鏈首先合成較短的片段,然後再由連線酶鏈成大分子DNA。一般說,原核生物的岡崎片段比真核生物的長。深入研究還證明,
前導鏈的
連續複製和
滯後鏈的
不連續複製在生物界具有普遍性,故稱為
DNA雙螺旋的
半不連續複製。
 岡崎片段
岡崎片段3.複製的引發和終止
所有的DNA的複製都是從一個固定的起始點開始的,而DNA
聚合酶只能延長已存在的DNA鏈,不能從頭合成DNA鏈,新DNA的複製是如何形成的?經大量實驗研究證明,DNA複製時,往往先由
RNA聚合酶在DNA模板上合成一段RNA引物,再由聚合酶從RNA引物3’端開始合成新的DNA鏈。對於
前導鏈來說,這一引發過程比較簡單,只要有一段RNA引物,DNA聚合酶就能以此為起點,一直合成下去。對於
後隨鏈,引發過程較為複雜,需要多種蛋白質和酶參與。後隨鏈的引發過程由
引發體來完成。引發體由6種蛋白質構成,預引體或引體前體把這6種蛋白質結合在一起並和
引發酶或引物過程酶進一步組裝形成引發體。引發體似火車頭一樣在後隨鏈分叉的方向前進,並在模板上斷斷續續的引發生成
滯後鏈的引物RNA短鏈,再由
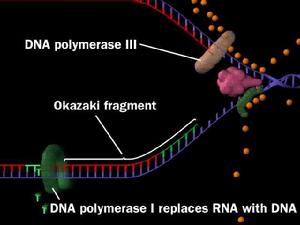
DNA聚合酶III作用合成DNA,直至遇到下一個引物或岡崎片段為止。由RNA酶H降解RNA引物並由DNA聚合酶I將缺口補齊,再由DNA連線酶將每兩個岡崎片段連在一起形成
大分子DNA.。
端粒和端粒酶
1941年美籍印度人
麥克林托克(McClintock)就提出了
端粒(telomere)的假說,認為染色體末端必然存在一種特殊結構——端粒已知染色體端粒的作用至少有二:①保護染色體末端免受損傷,使染色體保持穩定;②與
核纖層相連,使染色體得以定位。
在弄清楚DNA複製過程之後,20世紀70年代科學家對DNA複製時新鏈5’端的RNA引物被切除後,空缺是如何被填補的提出了質疑。如不填補豈不是DNA每複製一次就短一點。以
後隨鏈複製為例,當RNA引物被切除後,岡崎片段之間是由DNA聚合酶I催化合成的DNA填補之,然後再由DNA連線酶將它們連線成一條完整的鏈。但是DNA聚合酶I催化合成DNA時,需要自由3’—OH作為
引物,最後餘下子鏈的5’無法填補,於是染色體就短了一點。在正常
體細胞中普遍存在著染色體每複製一次
端粒就短一次的現象。人們推測,可能一旦端粒縮短到某一閾限長度以下時,它們就會發出一個警報,指令細胞進入衰老;或許是當細胞判斷出它們的染色體已變得太短了,於是分裂也就停止了,造成正常體細胞壽命有一定界限。但是在癌細胞中染色體端粒卻一直維持在一定長度上,這是為什麼?這是因為DNA複製後,把染色體末端短缺部分補上需要
端粒酶,這是一種含有RNA的酶,它既解決了模板,又解決了引物的問題。在
生殖細胞和85%癌細胞中都測出了端粒酶具有活性,但是在正常體細胞中卻無活性,20世紀90年代中期,Blackburn首次在原生動物中克隆出端粒酶
基因。
端粒酶在癌細胞中具有活性,它不僅使癌細胞可以不斷分裂增生,而且它為癌變前的細胞或已經是癌性的細胞提供了時間,以積累附加的突變,即等於增加它們複製,侵入和最終轉移的能力。同時人們也由此萌生了開發以
端粒為靶的藥物,即通過抑制癌細胞中
端粒酶活性而達到治療癌症的目的。
至於真核細胞DNA末端的結構特點,早就在1978年Blackburn就以原生動物四膜蟲(一種纖毛蟲)為例說明之:①迥紋形式的
髮夾環;②僅由C,A組成的簡單序列大量重複(C4A2)20~70;③鏈上有許多缺口(nicks)。
 岡崎片段
岡崎片段 岡崎片段
岡崎片段 岡崎片段
岡崎片段 岡崎片段
岡崎片段 岡崎片段
岡崎片段 岡崎片段
岡崎片段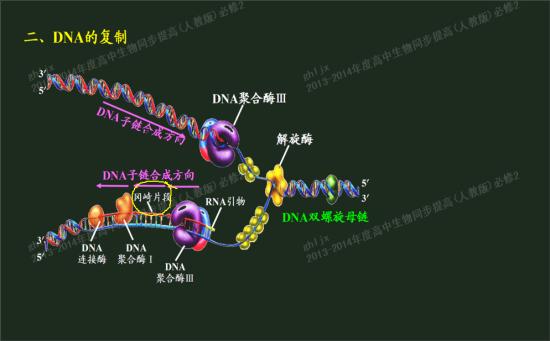
 岡崎片段
岡崎片段 岡崎片段
岡崎片段 岡崎片段
岡崎片段 岡崎片段
岡崎片段 岡崎片段
岡崎片段 岡崎片段
岡崎片段