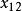簡介
近代有關液體多組分體系的分子熱力學的理論發展,則是基於局部組成的概念。在液態多組分體系中,局部組成與總體組成不同,它是由於假設
分子間由於不同大小及不同作用力所造成的短距離非隨機分子排列而來。
Wilson在提出局部組成概念時認為:在二元
混合物中,由於1-1、1-2和2-2分子對相互作用不同,在任何一個分子的近鄰,其局部的組成(局部分子分數)和混合物的總體組成(混合物的分子分數)不一定相同。例如,當1-1、2-2的相互作用明顯大於1-2時,在分子1周圍出現分子1的機率將高些。同樣,在分子2的周圍出現分子2的機率也將高些。相反,當1-1、2-2的相互作用顯著小於1-2時,則在某分子近鄰出現異種分子的機率將會大一些。這樣在某個分子(中心分子)周圍的局部範圍內,其組成和總體組成會不同。
問題簡述
當兩種物質形成
混合物時,由於組元1與組元2的分子間相互作用情況不同,混合物中各組元的分子分布情況應該不是隨意的、均勻的。例如當分子1與分子1、分子2與分子2之間的
吸引力要大於分子1與分子2之間的吸引力時,在分子1或分子2的周圍應有較多些同類分子所環繞;反之,分子1和分子2就會儘可能地相互接近,在分子1或分子2的周圍應有較多些異類分子所環繞。亦就是說,如果分子1或分子2的
摩爾分數為
和
。,那么由於組元分子間相互作用情況不同,在各個分子周圍會出現
和
不同的局部濃度,即在
微觀局部處出現了不均勻性。
可能存在的局部濃度
在二元系混合物中會可能存在四種局部濃度,即:
局部濃度的關係
核心問題
局部組成概念中核心問題是如何處理局部濃度與總體濃度的關係。
Wilson模型
Wilson方程
分子2的摩爾分數
越大,它出現於分子1周圍的
機率也越大;同時,分子1與分子2之間的相互吸引作用能
越大,分子2出現於分子1周圍的機率也越大,相互作用能的影響可以用Boltzmann因子來表達,即
。將這兩個因素結合起來考慮,我們可以寫出:
其中,
是
比例係數,我們並不清除具體的數值,也沒有必要知道。可合理的假設它們是相等的,由此得到:
故有:
上述各式即為Wilson依據經驗,考慮了各組分子之間相互作用的影響,擴展了Flory-Huggins方程式,稱為Wilson方程。
超額自由焓的Wilson表達式
如果將分子1和分子2的濃度單位改為局部
體積分數為:
式中
為物質i的
摩爾體積。因而局部體積分數
可表示為:
又知Flory和Huggins提出的無熱溶液的
函式表示式為:
Wilson建議將局部體積分數代替Flory和Huggins提出的無熱溶液的
函式中總體平均體積分數,得:
此時可得到
多元系中超額
自由焓的Wilson表達式:
Wilson參數
Wilson參數的定義式為:
Wilson參數的特點如下:
(1)對
理想溶液,
與1偏離越遠,說明討論體系的非理想性越強;
(2)對
非理想溶液,一般有
。對於同類分子,有關係
;此外,當
均大於1時,表示討論的超額自由焓
;當
均小於1時,表示討論的超額自由焓
;當
中一個大於1,另一個小於1時,表示討論體系的非理想性不甚明顯。
特點
Wilson方程由於其形式簡明、有一定理論依據、計算精度較高等優點而引起研究者的注意,但是Wilson方程也有其局限性,如不能用於部分
互溶體系等。