基本介紹
- 中文名:實際溶液
- 外文名:realsolution
- 定義:實際存在的溶液
- :
- 別稱:真實溶液
研究背景
計算方法
活度

實際溶液的偏差
正偏差
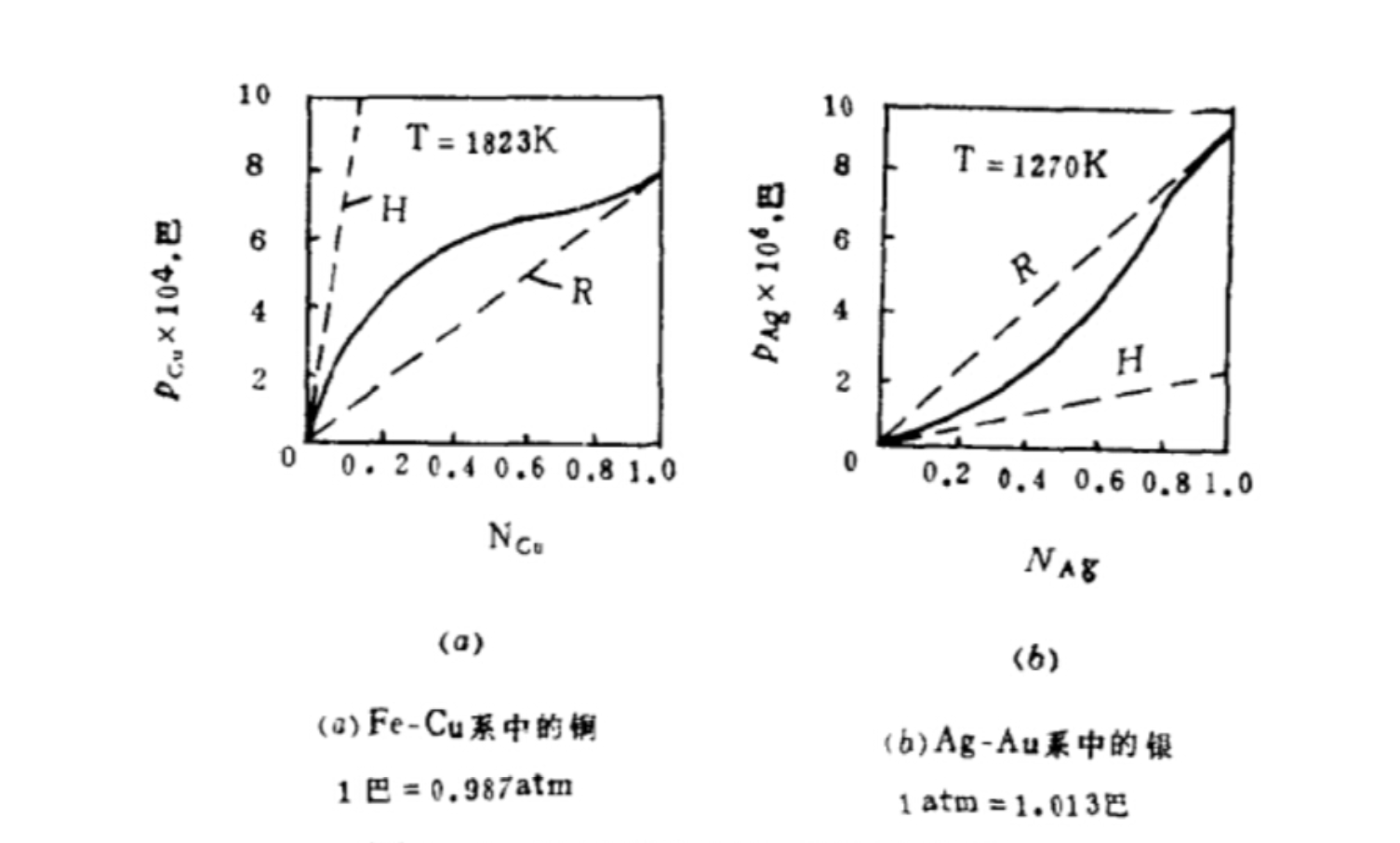 正偏差與負偏差
正偏差與負偏差
 正偏差與負偏差
正偏差與負偏差實際溶液是實際存在的溶液,實際溶液的溶劑不遵守拉烏爾定律,溶質也不遵守亨利定律。...
溶液是由至少兩種物質組成的均一、穩定的混合物,被分散的物質(溶質)以分子或更小的質點分散於另一物質(溶劑)中。物質在常溫時有固體、液體和氣體三種狀態。因此...
比例係數γ(i)稱為離子i的活度係數,用它來表示實際溶液和理想溶液之間偏差的大小.活度表示在溶液中對離子濃度的修正值,活度是當真實溶液在理想狀況下的離子濃度,...
福馬林″〈formalin;福美林〉是"甲醛″〈formaldehyde〉(HCHO))的水溶液,外觀無色透明,具有腐蝕性,且因內含的甲醛揮發性很強,開瓶後一下子就會散發出強烈的...
電解質溶液是指溶質溶解於溶劑後完全或部分解離為離子的溶液。溶質即為電解質,電解質不一定能導電,而只有在溶於水或熔融狀態是電離出自由移動的離子後才能導電。...
高分子溶液(macromolecular solution)是膠體的一種,在合適的介質中高分子化合物能以分子狀態自動分散成均勻的溶液,分子的直徑達膠粒大小。...
膠體溶液是指一定大小的固體顆粒藥物或高分子化合物分散在溶媒中所形成的溶液。其分散體系的質點一般在1~100納米之間,分散媒大多數為水,少數為非水溶媒。固體顆粒...
水分子通過半透膜向溶液擴散的現象稱為滲透現象,簡稱滲透;溶液促使膜外水分子向內滲透的力量即為滲透壓或滲透吸水力;以血漿的正常滲透壓(7.6個大氣壓或5776毫米汞...
溶質含量極少的溶液。稀溶液中溶質的摩爾分數趨近於零,而溶劑的摩爾分數趨近於1,所以稀溶液非常接近於理想溶液,稀溶液中溶劑的行 為與它處於理想溶液時的行為相同...
溶液調濕是常規的空調系統,夏季普遍採用熱濕耦合的控制方法,對空氣進行降溫與除濕處理,同時去除建築物內的顯熱負荷與潛熱負荷。...
《溶液除濕》共分為10章,對溶液除濕空氣處理方式的相關研究及套用進行了全面闡述,涵蓋了溶液除濕方式的基礎理論、基本流程、處理裝置及實際套用等多個方面,主要內容...
有效濃度又稱活度,是實際溶液對理想溶液的校正濃度。...... 有效濃度又稱活度,是實際溶液對理想溶液的校正濃度。中文名 有效濃度 又稱 活度 屬於 實際溶液對理...
CuSO4與檸檬酸鈉溶液和Na2CO3溶液混合時生成檸檬酸絡銅離子,檸檬酸絡銅離子與...檸檬酸鈉比較穩定,實際鹼性也不強,不易還原銅離子產生氧化亞銅沉澱,因此該試劑可...
是分析化學中的一個名詞。含義是以1升溶液中所含溶質的摩爾數表示的濃度。以單位體積里所含溶質的物質的量(摩爾數)來表示溶液組成的物理量,叫作該溶質的摩爾...
但實際工作中存在相互作用,並且吸光物質濃度越大,相互作用也越大,偏離朗伯-比耳定律的程度也越嚴重,所以吸光分析應在稀溶液中進行。...
