在物體體積不變的情況下,單位質量的某種物質溫度升高1K (開爾文)所需吸收的熱量,叫做該種物質的“定容比熱容”以符號Cv表示,國際單位是:J/(kg·K)。
基本介紹
- 中文名:定容比熱容
- 條件:物體體積不變的情況
- 符號表示:Cv
- 國際單位:J/(kg·K)
計算對象
一般定義



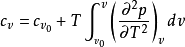


與定壓比熱容
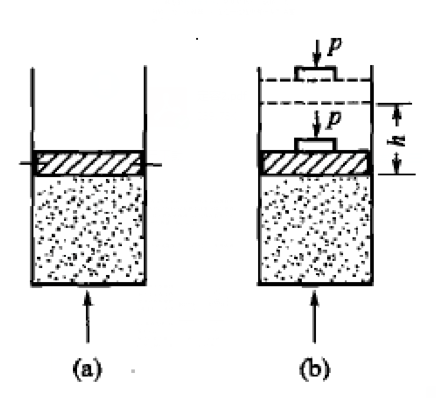 定容加熱與定壓加熱
定容加熱與定壓加熱


在物體體積不變的情況下,單位質量的某種物質溫度升高1K (開爾文)所需吸收的熱量,叫做該種物質的“定容比熱容”以符號Cv表示,國際單位是:J/(kg·K)。



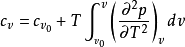


 定容加熱與定壓加熱
定容加熱與定壓加熱


在物體體積不變的情況下,單位質量的某種物質溫度升高1K (開爾文)所需吸收的熱量,叫做該種物質的“定容比熱容”以符號Cv表示,國際單位是:J/(kg·K)。...
定壓比熱容Cp:是單位質量的物質在壓力不變的條件下,溫度升高或下降1℃或1K所吸收或放出的能量。定容比熱容Cv:是單位質量的物質在容積(體積)不變的條件下,溫度...
在壓強不變的情況下,單位質量的某種物質溫度升高1K所需吸收的熱量,叫做該種物質的定壓比熱容,用符號Cp表示,國際制單位是:J/(kg·K)。對於同種氣體,定壓比熱...
比熱容比指的是定壓比熱Cp與定容比熱Cv之比,通常用符號γ表示,即γ=Cp/Cv,是描述氣體熱力學性質的一個重要參數。...
計算由N個同類分子組成的理想氣體系統的比熱容,通常先求出玻耳茲曼統計中分子的配分函式q:然後將系統內能在體積V保持不變的情況下對溫度T求導得出定容熱容: 若將...
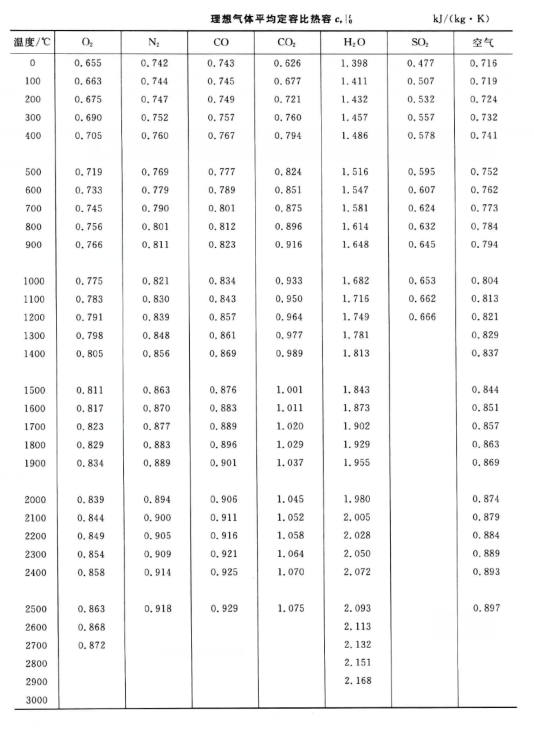
空氣的比熱容沒有確定值,即便是在溫度確定時,通常使用定壓比熱容或定容比熱容來反映空氣比熱容的大小,這兩者都與溫度有關(溫差不太大時可認為基本相等)。一定...
溶液比熱容正文 編輯 單位質量的溶液在一定條件下溫度改變 1℃時與環境交換的熱量。溶液的定容比熱容cV和定壓比熱容cp的定義為:式中CV、Cp為溶液的定容熱容和...
物質的比熱容與所進行的過程有關。在工程套用上常用的有定壓比熱容Cp、定容比熱容Cv和飽和狀態比熱容三種。定壓比熱容Cp:是單位質量的物質在壓力不變的條件下,...
變比熱容固體材料的比熱容隨溫度變化的規律 編輯 固體材料比熱容是溫度的函式,一般情況下,固體的比熱容隨溫度升高而增加,在低溫時增加較快,在高溫時增加較慢。...
在壓強不變的情況下,單位質量的某種物質溫度升高1K所需吸收的熱量,叫做該種物質的定壓比熱容,用符號Cp表示。對於同種氣體,定壓比熱容一般比定容比熱容大。...
平均比熱容average specific heat capacity比熱容的值與溫度有關,在溫度1,u和TZK之間物體的比熱容的平均值叫平均比熱容。 [1] 參考資料 1. 化學化工大辭典 詞條...
作為某種物質的物理性質之一,該物質的比熱容是指當單位質量該物質吸收或放出熱量...經常用到的是系統在等壓過程和等容過程的熱容,分別稱為定壓熱容Cp和定容熱容...
其中Cp為恆壓下的比熱,它套用於幾乎所有食品加熱和製冷加工上只有帶有氣體的食品計算時需要區別Cp和恆容比熱容Cv。M為食品質量(單位為kg)。中文...
單位質量物體的熱容稱為比熱容。設物體的溫度由T1K升高至T2K時吸熱為Q,則Q/...和定容熱容Cv。對實際氣體和液體來說,定壓熱容不僅同溫度有關,還同所處的...
摩爾定容熱容又稱氣體的摩爾定體熱容,是指1mol氣體在體積不變而且沒有化學反應與相關的條件下,溫度改變1K(或1度)所吸收或放出的熱量,用Cv表示,其數值可以由...
單位質量物體的熱容稱為比熱容。設物體的溫度由T1K升高至T2K時吸熱為Q,則Q/...和恆容熱容Cv。對實際氣體和液體來說,定壓熱容不僅同溫度有關,還同所處的...
