安可達是國內首個獲批上市貝伐珠單抗生物類似藥。
基本介紹
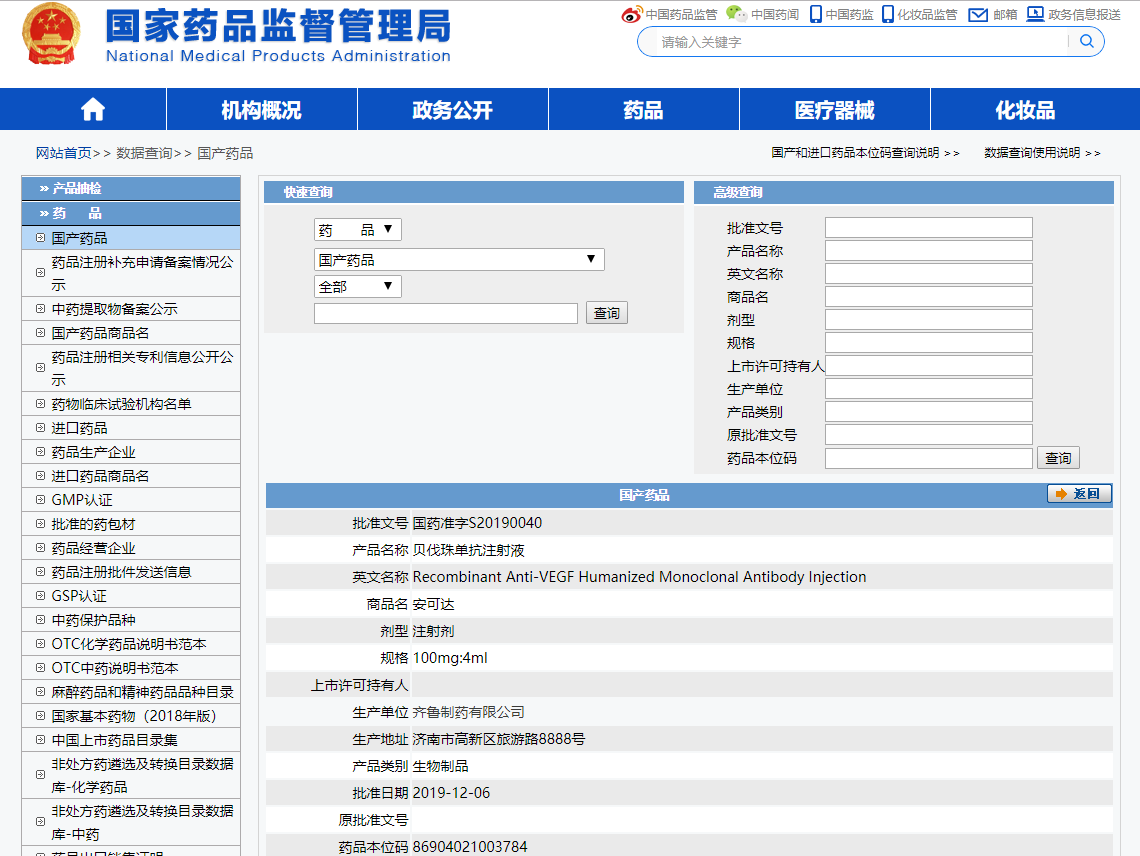
- 藥品名稱:貝伐珠單抗注射液
- 別名:安可達
- 外文名稱:Recombinant Anti-VEGF Humanized Monoclonal Antibody Injection
- 主要適用症:肺癌、結直腸癌
- 獲批時間:2019年12月6日
發展歷史
社會意義
適應症
規格
產品類別
商品名

安可達是國內首個獲批上市貝伐珠單抗生物類似藥。

安可達技術(蘇州)有限公司於2019年12月06日成立。法定代表人顧晨傑,公司經營範圍包括:工業網際網路和雷射領域的技術開發、技術諮詢、技術服務、技術轉讓;研發、設計、...
安可達是國內首個獲批上市貝伐珠單抗生物類似藥。... 2019年12月,國家藥品監督管理局批准齊魯製藥有限公司研製的貝伐珠單抗注射液(商品名:安可達)上市註冊申請。該藥...
四川安可達新能源科技有限公司於2018年05月18日成立。法定代表人羅凡雲,公司經營範圍包括:研發、生產及銷售:新能源汽車連線器及充電連線裝置、電器及組件、汽車零...
江蘇安可達消防安全工程有限公司於2016年02月26日在南通市工商行政管理局登記成立。法定代表人陳建春,公司經營範圍包括消防安防工程的設計、施工、安裝及維護;消防設施...
深圳市安可達建材有限公司於2012年08月23日成立。法定代表人馬林昌,公司經營範圍包括:一般經營項目是:建築材料、化工產品(不含危險化學品,易製毒化學品、成品油)...
安可達AK-607編輯 鎖定 本詞條缺少概述圖,補充相關內容使詞條更完整,還能快速升級,趕緊來編輯吧!內置220倍一體化攝像機,中英文螢幕選單功能、可顯示地址、預置位...
安可達AK-CH2372是一款中型企業設備類型紅外防水攝像機。... 安可達AK-CH2372是一款中型企業設備類型紅外防水攝像機。中文名 安可達AK-CH2372 適用範圍 中型企業...
安可達AK-CH2336主要參數 編輯 適用範圍中型企業設備類型紅外防水攝像機圖象解析度(dpi)PAL:512(H)×582(V);NTSC:512(H)×492(V)視頻輸出1 Vp-p, 75Ω(...
安可達AK-606具有4條花樣學習軌跡、每條存儲2分鐘;... 安可達AK-606具有4條花樣學習軌跡、每條存儲2分鐘; 基本參數安可達 AK-606安防監控類型...
安可達AK-608VBS是1.0Vp-p/75Ω,通訊接口是RS-485。... 安可達AK-608VBS是1.0Vp-p/75Ω,通訊接口是RS-485。基本參數安可達 AK-608...
安可達AK-CH2352一款紅外防水攝像機,適用於中型企業。... 安可達AK-CH2352一款紅外防水攝像機,適用於中型企業。中文名 安可達AK-CH2352 適用範圍 中型企業 ...
安可達AK-CH2331 類型 攝像機 圖象解析度 512(H)×582(V) NTSC 512(H)×492 主要參數適用範圍中型企業設備類型紅外防水攝像機圖象解析度(dpi)PAL:512(H)...
安可達AK-CH2635是一款紅外防水攝像機,圖象解析度(dpi)PAL:512(H)×582(V) 。... 安可達AK-CH2635是一款紅外防水攝像機,圖象解析度(dpi)PAL:512(H)×582(...
安可達AK-CB26E是一款攝像機,圖象解析度是512(H)×582(V),適用於中型企業。... 安可達AK-CB26E是一款攝像機,圖象解析度是512(H)×582(V),適用於中型企業。
