Wilson病又稱威爾遜氏變性(hepatolenticular degeneration),本病於1911年首先由Wilson報導,此為一種以青少年為主的常染色體隱性遺傳性疾病,是先天性銅代謝障礙性疾病。臨床上以肝損害、錐體外系症狀與角膜色素環等為主要表現,伴有血漿銅藍蛋白缺少和胺基酸尿症。
基本介紹
- 別稱:Wilson病
- 中醫病名:威爾遜氏變性
- 英文名稱:hepatolenticular degeneration
- 英文別名:Wilson
概述,疾病名稱,英文名稱,別名,分類,ICD號,流行病學,病因,發病機制,銅代謝合成障礙,膽道銅排泄障礙,病理表現,威爾遜氏變性的臨床表現,神經精神症狀,肝臟症狀,角膜色素環,關節病變,腎臟損害,血液系統損害,其他臨床表現,臨床分型,病程分期,威爾遜氏變性的併發症,實驗室檢查,血清CP及血清銅氧化酶活性測定,微量銅測定,肝腎功能檢查,輔助檢查,骨關節X線檢查,神經影像學檢查,腦電圖檢查,誘發電位檢查,正電子發射斷層掃描(PET),基因診斷,診斷,鑑別診斷,威爾遜氏變性的治療,常規治療方法,藥物治療,手術治療,基因診斷與治療,其他有骨骼脫鈣者,對症治療,中醫治療,療效評價,預後,威爾遜氏變性的預防,相關藥品,相關檢查,
概述
Wilson病又稱威爾遜氏變性(hepatolenticular degeneration),本病於1911年首先由Wilson報導,此為一種以青少年為主的常染色體隱性遺傳性疾病,是先天性銅代謝障礙性疾病。臨床上以肝損害、錐體外系症狀與角膜色素環等為主要表現,伴有血漿銅藍蛋白缺少和胺基酸尿症。
威爾遜氏變性系常染色體隱性遺傳性疾病,受累基因與銅代謝紊亂有關,與位於染色體的酯酶D基因與視網膜母細胞瘤基因緊密連鎖。
威爾遜氏變性的發病機制有膽道排泄減少、銅藍蛋白合成障礙、溶酶體缺陷、金屬巰蛋白基因異常及調節基因異常等學說,目前以前二種學說獲得多數學者贊同。
少數威爾遜氏變性患者可出現精神症狀。少兒期緩慢進行性食欲不振、輕度黃疸、肝臟腫大和腹水。部分患者有緩慢進行性脾臟腫大,並引致貧血、白細胞及(或)血小板減少等脾功能亢進。
防治威爾遜氏變性應及早確診,及時糾正患者銅代謝的正平衡狀況。注意減少食物含銅量(<1mg/d),限制含銅多的飲食,如堅果類、朱古力、豌豆、蠶豆、玉米、香菇、貝殼和螺類、蜜糖、動物肝和血等。高胺基酸、高蛋白飲食能促進尿銅排泄。
對威爾遜氏變性患者的家族成員測定血清銅藍蛋藍蛋白、血清銅、尿銅及體外培養皮膚成纖維細胞的含銅量有助於發現WD症狀前純合子及雜合子,發現症狀前純合子可以及早治療。雜合子應禁忌與雜合子結婚以免其子代發生純合子。產前檢查如發現為純合子,應終止妊娠,以杜絕患者的來源。
疾病名稱
威爾遜氏變性
英文名稱
hepatolenticular degeneration
別名
Wilson病;威爾遜變性;肝豆狀核變性;威爾遜氏病;威爾遜氏綜合徵;威爾遜病
分類
1.消化科 > 肝膽疾病 > 肝臟先天性及代謝性疾病
2.風濕科 > 瀰漫性結締組織病 > 代謝性骨關節病
3.神經內科 > 運動障礙疾病
ICD號
K76.8
流行病學
威爾遜氏變性人群發病率為0.5/10萬~3/10萬,病人同胞患病風險為1/4,人群中雜合子或病變基因攜帶者頻率為1/100~1/200,陽性家族史達25%~50%。患病率約為1/3萬活嬰,雜合子頻率約1%。絕大多數限於一代同胞發病或隔代遺傳,連續兩代發病罕見。
Wilson病在大多數歐美國家罕見,某些國家和地區,如義大利南部撒丁島及西西里島、以色列及東歐猶太人和羅馬尼亞發病率較高,日本發病率高達1/2萬。我國尚無準確統計資料,但臨床報告病例相當多見,據不完全統計,1950~1998年國內有關WD文獻報告就有791篇,報告病例4501例。
病因
威爾遜氏變性的基本病因是體內各組織,尤其是肝、腦、腎、角膜等處銅沉積過多,導致組織損害和病變。
威爾遜氏變性系常染色體隱性遺傳性疾病,受累基因與銅代謝紊亂有關,與位於染色體的酯酶D基因與視網膜母細胞瘤基因緊密連鎖。
發病機制
關於威爾遜氏變性發生機制有以下幾個學說:
①該類患者膽汁中與銅結合的正常物質缺陷,可能是鵝脫氧膽酸與牛磺酸結合缺陷,導致膽汁分泌銅功能障礙。不支持這一學說的證據是:該類患者膽汁銅結合蛋白沒有質的改變,而且沒有證據表明該類患者存在膽酸代謝異常。
②肝臟銅結合蛋白合成異常,導致蛋白對銅的親合力增加,支持這一學說的證據有,Wilson病患者銅結合蛋白(肝臟銅蛋白)對銅的結合常數是原發性膽汁性硬化患者該常數的4倍,但人們對資料的分析方法提出質疑,因而,Wilson病中異常蛋白對銅的高親和力是否就是Wilson病的形成機制有待進一步闡明。
③最合理的學說,是肝臟細胞的溶酶體參與了銅的代謝過程,實驗觀察到,Wilson病患者肝細胞溶酶體含量高出對照的40倍,認為Wilson病患者肝細胞溶酶體缺陷干擾了銅由溶酶體分泌到膽汁中去的過程,從而導致了Wilson病患者肝臟含銅量的增加。
總之,Wilson病不是由於腸道對銅吸收增加,而是由於膽道對銅的分泌障礙,這一障礙是先天性的,有基因缺陷的患者,在生後3個月不能合銅正平衡代謝轉為正常,使銅正平衡代謝持續存在,結果導致了銅在體內的堆積。
威爾遜氏變性的發病機制有膽道排泄減少、銅藍蛋白合成障礙、溶酶體缺陷、金屬巰蛋白基因異常及調節基因異常等學說,目前以前二種學說獲得多數學者贊同。
銅代謝合成障礙
多數實驗室用64Cu對體內銅代謝研究證明,血清銅藍蛋藍蛋白減少是威爾遜氏變性體內銅積蓄的主要原因。但銅藍蛋白為何缺乏,尚未完全闡明。Bichtrrich根據銅藍蛋白電泳發現,正常成人是由先構成的未分化的銅藍蛋白D在肝臟內經肽酶將其大部分轉化為銅藍蛋白C,然後由80%銅藍蛋白C與20%銅藍蛋白D構成銅藍蛋白,而威爾遜氏變性患者僅存在銅藍蛋白D,而幾乎沒有C部分,故引致銅藍蛋白合成障礙。
膽道銅排泄障礙
正常成人每日需從食物中吸收銅2~5mg,銅離子進人體內後,大部分先與白蛋白疏鬆結合為直接反應銅,運送到肝臟,在肝細胞內轉與各種球蛋白主要是α2-球蛋白牢固地結合為銅藍蛋白(間接反應銅)。一般血漿中的總銅量90%~95%以銅藍蛋白形式存在,僅約5%的銅與白蛋白、胺基酸和多肽疏鬆結合存在,後者除在各臟器內自由通過細胞膜與血漿銅交換外,大部分由溶酶體攝取經膽管從糞便中排出,少數由尿排出。即正常人從食物中吸收的銅,除體內生理需要外,過剩的銅絕大部分從膽管中膽汁排泄。Frommer率先測定8例威爾遜氏變性患者及10例對照組的十二指腸液內含銅量,發現威爾遜氏變性組顯著低於對照組,提出膽管排銅障礙是造成威爾遜氏變性患者體內銅蓄積的重要原因。
銅是人體必需的微量元素,作為輔基參與多種重要生物酶合成。正常成人每日從飲食攝取銅2~5mg,約30%在胃、十二指腸及空腸上端吸收入血,大部分與白蛋白疏鬆結合進入肝細胞,在肝細胞中銅與α2球蛋白牢固結合成銅藍蛋白(ceruloplasmin,CP),CP有氧化酶活性,呈深藍色,剩餘銅被結合到其他特殊銅蛋白中。正常人每日膽汁排銅量約1200μg。約70%的CP存在於血漿,其餘存在於血管外,血液循環中90%~95%的銅結合在CP上。CP有重要生理功能,可作為銅的供體參與細胞色素C及其他銅蛋白合成,具有亞鐵氧化酶作用,將亞鐵氧化為高鐵狀態,使氧還原成水。剩餘的銅通過膽汁、尿液和汗液排出體外。威爾遜氏變性患者銅藍蛋白合成障礙,90%以上患者血清CP量明顯減少,但肝內前銅藍蛋白(Apo-CP)含量及結構正常,提示生化障礙發生在肝內Apo-CP與銅結合環節,CP合成障礙是本病基本的遺傳缺陷。肝內銅代謝紊亂引起血清CP合成障礙,導致血清銅及CP降低,尿銅排泄增多,膽道排銅減少,過量銅在肝臟、腦、腎臟及角膜等組織沉積致病,但約5%的Wilson病人血清CP水平正常難以解釋。
近年研究已確定CP基因位於13號染色體(13q14-21),有多種突變型,表達CP是132kD糖蛋白,由1046個胺基酸殘基組成單條多肽鏈,結合6個三種不同類型銅離子。威爾遜氏變性患者銅藍蛋白前體無異常,基因及表達產物無變化,從遺傳基因角度不能解釋威爾遜氏變性血清CP明顯減少。基因突變有明顯遺傳異質性,突變方式包括轉換(A→G)、顛換(C→G)、缺失(CCC→CC)及插入(T→TT),其中C→G顛換最常見,造成編碼胺基酸變化(如組氨酸變成谷氨酸、天門冬氨酸變成絲氨酸)及移碼突變,至今發現的突變均涉及ATP酶功能區。威爾遜氏變性基因突變引起編碼P型ATP酶(也稱ATP7B)功能改變,ATP7B主要功能是銅轉運,部分或全部功能喪失,不能將多餘銅離子從細胞內轉運出去,使銅離子在特定器官和組織沉積致病。
威爾遜氏變性的分子發病機制存在種族差異,歐美患者ATP7B基因高頻突變點是14號外顯子,處於ATP7B基因磷酸化區及ATP結合區,兩個功能區基因突變使功能消失,導致酶缺乏,轉運過程中能量引起銅離子在細胞內滯留。中國WD患者高頻突變點8號外顯子在整個ATP7B基因中處於跨膜功能區,引起蛋白質一級、二級結構改變,導致細胞膜銅轉運停滯而致病。
病理表現
威爾遜氏變性的病理表現為大量的銅沉積於組織。病變特徵性地分布於腦組織、肝臟、腎臟及角膜等處。腦病變以殼核最早和明顯,其次為蒼白球、尾狀核及大腦皮質,丘腦底核、紅核、黑質、丘腦及齒狀核亦可受累。神經元顯著減少或完全脫失,軸突變性和星形膠質細胞增生。角膜邊緣後彈力層及內皮細胞漿內,可見棕黃色細小銅顆粒沉積,嚴重者角膜中央區及間質細胞中也可見到。肝臟外表及切面可見大小不等結節或假小葉,頗似壞死後肝硬化,肝細胞脂肪變性,含銅顆粒。電鏡下可見肝細胞內線粒體緻密、線粒體嵴消失及粗面內質網斷裂等。
威爾遜氏變性的臨床表現
臨床主要表現為神經精神症狀與肝臟症狀兩大方面。歐美報導,約70%的威爾遜氏變性患者以神經症狀為首發症狀,肝臟症狀次之。國內有文章報導以神經症狀起病者占47.48%,肝臟症狀起病者占39.96%,其次為骨關節及腎臟損害症狀。
威爾遜氏變性通常發生於兒童期或青少年期,以肝臟症狀起病者平均約年齡11歲,以神經症狀起病者約平均19歲,少數可遲至成年期。絕大多數患者先出現神經症狀,少數先出現肝臟症狀,也有少數患者首發症狀為急性溶血性貧血、皮下出血、鼻衄、腎功能損害及精神症狀等。起病緩慢,少數由於外傷、感染等原因呈急性發病,最終都會出現肝臟及神經損害症狀。
神經精神症狀
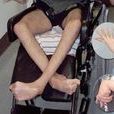
威爾遜氏變性突出的神經系統表現是錐體外系症狀。最初的表現常是上學時有動作障礙,特別是書寫困難及語言困難,可出現一側或兩側上肢震顫,於隨意運動時增強,靜息時減輕,重者可累及軀幹、下肢及頭部。有時可出現舞蹈-手足徐動症等不自主運動。肌強直可以是間歇性的,也可呈持續性。精神症狀常見,表現不一,可有好攻擊、孩子氣、欣快等。智力可下降。少數威爾遜氏變性病人可有癲癇發作,巴氏征呈陽性。
(1)震顫:是常見首發症狀。早期常限於上肢,自一側手部開始,先為細小震顫,逐漸變為粗大震顫,隨意運動時加重,可呈靜止性、意向性或姿勢性震顫,往往幾種震顫形式合併出現。隨病情進展震顫可波及四肢、頭部及下頜等,漸延及全身,多表現為快速、節律性,粗大似撲翼樣的震顫,可並有運動時加重的意向性震顫。
(2)發音障礙與吞咽困難:表現講話聲音低沉、含糊或嘶啞,緩慢或斷續,嚴重時發不出聲來,是舌、唇、咽、喉和下頜運動減慢所致;流涎及吞咽困難也很常見,是咽喉肌、舌肌及面肌肌強直所致。多見於兒童期發病的威爾遜氏變性。說話緩慢似吟詩,或音調平坦似念經,或言語斷輟似吶吃;也可含糊不清、暴發性或震顫性語言。吞咽困難多發生於晚期患者。
(3)肌張力改變:大多數患者肌張力呈齒輪樣、鉛管樣增高,往往引致動作遲緩、面部表情減少、寫字困難、步行障礙等。少數舞蹈型患者伴肌張力減退。肌張力障礙累及面部及口腔肌肉時出現“面具臉”、苦笑貌、怪異表情或口面部不自主運動等,累及肢體和軀幹出現肢體僵硬、動作遲緩、手指運動緩慢、屈曲姿勢及變換姿勢困難等,步態異常表現起步困難、步履僵硬、拖曳而行,嚴重者類似帕金森病慌張步態,肢體舞蹈樣動作、手足徐動等也不少見。
(4)癲癇發作:較少見。國內曾有人總結418例威爾遜氏變性中,1l例(2.6%)於病程中出現不同類型癲癇發作,其中10例為全身強直-陣攣發作或部分性運動發作,僅1例為失神發作。
(5)精神症狀:早期病人智慧型多無明顯變化,但急性起病的兒童較早發生智力減退;大多數威爾遜氏變性具有性格改變,如自制力減退、情緒不穩、易激動等;重症可出現抑鬱、狂躁、幻覺、妄想、衝動等,可引起傷人自傷行為。少數患者以精神症狀為首發症狀,易被誤診為精神分裂症。
(6)可有較廣泛神經系統損害,如小腦損害導致共濟失調及語言障礙,錐體系損害出現腱反射亢進、病理反射和假性球麻痹等,下丘腦損害產生肥胖、持續高熱及高血壓等。
肝臟症狀
肝臟是威爾遜氏變性首先受累部位,約80%的患者發生肝臟症狀,多表現非特異性慢性肝病綜合徵,如倦怠、無力、食欲不振、肝區疼痛、肝腫大或縮小、脾腫大及脾功能亢進、黃疸、腹水、蜘蛛痣、食管靜脈曲張破裂出血及肝昏迷等,易誤診為病毒性肝炎。10%~30%的患者發生慢性活動性肝炎,少數表現無症狀性肝脾腫大,或僅轉氨酶持續升高無任何肝臟症狀。肝臟損害可使體內激素代謝異常,導致內分泌紊亂,青春期延遲,女性月經不調、閉經或流產史,男性出現乳房發育等。極少數患者以急性肝衰竭起病,可能由於肝細胞內銅向溶酶體轉移過快,引起溶酶體損害,導致肝細胞大量壞死。
以肝臟表現為首發症狀有:
(1)通常5~10歲發病。由於肝臟內銅離子沉積達超飽和,引起急性肝功能衰竭,即腹型威爾遜氏變性。臨床表現為,全身倦怠、嗜睡、食欲不振、噁心嘔吐、腹部膨脹及高度黃疸,病情迅速惡化,多於1周至1個月左右,常被誤診為重症病毒性肝炎而按“肝炎”搶救無效死亡,往往在其同胞被確診為HLD後,回顧病史時方考慮本病可能。倘若能早期診斷,予以確當、強力驅銅和庇肝綜合治療,半數以上可獲緩解。
(2)半數患者在5~10歲內,出現一過性黃疸、短期谷丙轉氨酶增高及(或)輕度腹水,不久迅速恢復。數年後當神經症狀出現時,肝臟可輕度腫大或不能捫及,肝功能輕度損害或正常範圍,但B超檢查已有不同程度損害。倘若在神經系統症狀出現前,及時行系統驅銅治療,常可長期防止肝臟和腦症狀出現。
(3)少兒期緩慢進行性食欲不振、輕度黃疸、肝臟腫大和腹水,酷似肝硬化的表現。經數月至數年,消化道症狀遷延不愈或日益加重,而漸漸出現震顫、肌僵直等神經症狀。神經症狀一旦出現,肝症狀迅速惡化,多於幾周至2~3個月內發展至肝性腦病。因此,對原因不明的肝硬化少兒患者,如進行詳細的神經系統檢查,往往能發現肌張力改變或病理反射等中樞神經系統陽性體徵,再進一步行銅代謝檢查,可獲得早期診斷和及時治療。
(4)部分青少年患者可表現緩慢進行性脾臟腫大,並引致貧血、白細胞及(或)血小板減少等脾功能亢進徵象,一般在脾切除及(或)門靜脈分流術後不久,出現神經症狀並迅速惡化,常於短期內死亡;少數患者因食管靜脈破裂致上消化道出血而迅速促發神經症狀。
(5)肝臟症狀發生於其他症狀後:
①先出現神經症狀,長期誤診或不規則驅銅治療,神經症狀遷延達晚期,漸發生黃疸、腹水乃至肝性腦病。
②以神經症狀獲得正確診斷,體檢時才發現輕度肝脾腫大及(或)肝功能異常。
角膜色素環
角膜色素環(Kayser-Fleisher環,K-F環):由於銅在角膜後彈力層沉積,肉眼或裂隙燈在角膜後彈力層周邊部可見棕色、灰色環。K-F環位於角膜與鞏膜交界處,在角膜內表面呈綠褐色或金褐色,寬約1.3mm。絕大多數見於雙眼,個別見於單眼,神經系統受累病人均可出現,有時需通過裂隙燈才可檢出。以往認為晚期出現向日葵白內障(sunflower cataract),但Walshe觀察15例新診斷的病人,11例(73.3%)有此白內障,少數患者出現晶狀體渾濁、暗適應下降及瞳孔對光反應遲鈍等。
關節病變
部分威爾遜氏變性病人有關節病變,常侵犯手、腕、膝關節,亦見於肘、肩、髖關節,兩側對稱。受累關節腫痛及壓痛,有輾軋音,無紅熱,晚期活動受限。病程似骨關節炎,因患者鈣磷代謝障礙,可有骨質疏鬆及骨折。
腎臟損害
銅離子在近端腎小管及腎小球沉積,造成腎小管重吸收障礙,出現腎性糖尿、多種胺基酸尿、磷酸鹽尿、尿酸尿、高鈣尿及蛋白尿等,少數患者可發生腎小管性酸中毒,伴發腎衰竭。並可產生骨質疏鬆、骨及軟骨變性等
血液系統損害
極少數威爾遜氏變性患者以急性溶血性貧血起病,大量銅從壞死肝細胞中釋放入血液,多見於青少年,大多數為致命性。部分患者因脾功能亢進導致全血細胞減少,出現鼻衄、牙齦出血及皮下出血等。
其他臨床表現
大部分威爾遜氏變性患者有皮膚色素沉著,面部及雙小腿伸側明顯。可出現眼調節功能減弱、集合能力及暗適應功能下降,發生心律失常等。
臨床分型
(1)潛伏型(亞臨床型)
一般為患者的一級親屬,在進行銅代謝篩選檢查時發現。
(2)顯性型(臨床表現型)
①腦型(以神經症狀為核心症狀)
A.廣義威爾遜氏變性型:臨床特徵為,一般於15歲以前發病;肌僵直顯著,表現為動作笨拙,言語納吃和不清等,震顫較輕,晚期呈全身扭轉痙攣。
B.扭轉痙攣型:亦是以肌僵直為主征,但病程發展迅速,於短期內呈現中高度全身扭轉痙攣狀態,並早期發生四肢攣縮、畸形及語言嚴重障礙。此型亦可歸入威爾遜氏變性型的急性進展型。
C.舞蹈-手足徐動型:是指以舞蹈運動、舞蹈-手足徐動或舞蹈手足徐動-肌張力障礙為初發症狀和主要表現。早期常無明顯的肝症狀和震顫、肌僵直等錐體外症狀。多於兒童、少年期起病。主要表現為擠眉、弄眼、扭鼻、咂嘴、擺頭、扭頸等頭面部不自主運動或/及四肢多部位扭轉、舞動等異常運動,少數呈投擲樣運動,臨床表現酷似小舞蹈病。肌張力減低或輕度鉛管樣增高不等。隨病程進展,常可能轉為典型肝豆狀變性型。
D.假性硬化型:臨床特徵為:大多於20歲以後起病,以姿位性震顫為主的全身震顫進行性加重,而肌僵直較輕,肝臟症狀較輕,出現也遲,一般達末期才發生明顯肝臟損害的臨床表現。
E.精神障礙型:大多數各型的威爾遜氏變性患者在病程中都程度不等地伴有欣快、情緒不穩、性格暴躁或主動性減少等症狀。而精神障礙型是指以重精神病樣症狀為初發症狀或核心症狀者,神經症狀較輕或缺如。主要症狀如狂躁或抑鬱、有豐富幻覺或/及妄想,可有拒食、毀物、自傷、傷人等行為。常易誤診為精神分裂症等各種重精神病。
②脊髓型或腦脊髓型
此型極少見,脊髓型臨床特徵為:多見於10~20歲男性患者,對稱性痙攣性截癱為主要表現。如伴有意識不清、言語錯亂和震顫等腦症狀,稱腦脊髓型。
③骨-肌型
Dustur首先報告一組9例印度裔的青少年威爾遜氏變性患者,臨床以佝僂病樣骨骼改變和肌病樣表現為特徵,而腦症狀和肝症狀較少、較輕,稱做骨-肌型肝豆狀變性。國內有報告觀察11例中國人骨-肌型患者,具有以下特徵:發病年齡5~20歲,平均11.18歲;常以骨關節疼痛、四肢近端為主的肌無力、肌萎縮等骨-肌症狀為首發症狀;早期較少並有神經症狀與肝臟症狀;病程進展緩慢,入院時平均病程5年;如不進行有效排銅治療,則隨病程進展亦可出現肌僵直、語言不清等錐體外系症狀。
④腹型
臨床特徵為,5~10歲前常以發熱、嚴重黃疸、中度腹水突然起病;進展迅速,迅速出現明顯食欲不振、高度黃疸和腹水;多於起病後2~4周內死於肝功能衰竭,常易被誤診為暴發性肝炎。生前無錐體外系症狀。
⑤腦-內臟混合型
本組以肝型最多見,臨床表現多樣,主要有下列特徵:青少年發生緩慢進行性脾大,酷似門靜脈高壓症;兒童期發生原因不明的進行性肝硬化,如晚期出現神經症狀,稱腦-肝型。另一部分腦型患者,不恰當或不規則治療而達晚期,常並有肝硬化等肝症狀,亦屬腦-肝型範疇。
腎型與腎-腦型以下肢水腫、尿蛋白增多、肉眼或鏡檢下血尿為首發症狀而無明顯神經症狀和肝臟症狀者稱腎型。腦型WD患者在病程中出現蛋白尿、血尿等腎臟損害或/及腎功能障礙者稱腎-腦型。
病程分期
關於威爾遜氏變性自然病程,理論上分四期:
Ⅰ期:銅在肝細胞質原始聚積直至達飽和狀態,臨床上無症狀;
Ⅱ期:銅從胞質轉入溶酶體,部分釋放入血。大多數(60%)患者銅的再分布是逐漸發生的,臨床表現不明顯,但是,如此過程進展快,血銅突然升高可致溶血,肝內快速再分布可致肝壞死或慢性活動性肝炎,可能發生肝功能衰竭;
Ⅲ期:肝外組織銅貯積,出現肝硬化、神經、角膜和腎損害,臨床有相應表現,可出現溶血,可死於肝功能衰竭,也可以再度緩解為無症狀;本期表現多樣,如肝硬化進展慢、肝外銅貯積慢,患者可多年無症狀,但進展快則臨床經過兇險;
Ⅳ期:即絡合物長期治療後的緩解期。
威爾遜氏變性的併發症
少數威爾遜氏變性患者可出現精神症狀。少兒期緩慢進行性食欲不振、輕度黃疸、肝臟腫大和腹水。部分患者有緩慢進行性脾臟腫大,並引致貧血、白細胞及(或)血小板減少等脾功能亢進。
實驗室檢查
血清CP及血清銅氧化酶活性測定
是威爾遜氏變性重要的診斷依據。
①血清銅藍蛋白測定:威爾遜氏變性患者血清CP<0.2g/L(正常值0.26~0.36g/L),甚至為零,血清CP值與病情、病程及驅銅療效無關,不能作為病情監測或療效觀察指標;新生兒血清CP值只有正常人的1/5,以後迅速升高,2~3個月達到成人水平;12歲前兒童血清CP矯正公式為:矯正後CP值=血清CP測定值×[(12-年齡)×1.7];須注意血清CP降低還見於腎病綜合徵、慢性活動性肝炎、原發性膽汁性肝硬化、某些吸收不良綜合徵、蛋白-熱量不足性營養不良等。
②威爾遜氏變性患者血清CP氧化酶活力<0.2密度(正常值0.2~0.532光密度)。
微量銅測定
①血清銅測定
正常人為14.7~20.5mmol/L,90%的威爾遜氏變性患者血清銅降低,血清銅與病情和療效無關,原發性膽汁性肝硬化、慢性活動性肝炎、腎病綜合徵及嚴重營養不良等患者血清銅也可降低。
②尿銅測定
多數威爾遜氏變性患者24小時尿銅量顯著增加,服排銅藥後尿銅進一步增高,體內蓄積銅大量排出後尿銅量漸降低,尿銅量可作為臨床調整排銅藥劑量參考指標;威爾遜氏變性患者通常尿銅量>200μg/24h(正常<50μg/24h),個別高達1200μg/24h,少數患者正常或稍高;青黴胺負荷試驗:口服青黴胺後正常人和未經治療患者尿銅明顯增高,但患者更顯著;慢性活動性肝炎、原發性肝硬化等尿銅量也增高。
正常人24h,Ⅰ期後或有臨床表現的Wilson病可達100μg/24h以上;Ⅱ期患者偶有增至>1000μg/24h者。但是,其他肝硬化、慢性活動性肝炎、膽汁淤積包括原發性膽汁性肝硬化也可升高,因而診斷價值不大,但可用作隨診D-青黴胺治療效果的一指標。
③肝銅量測定
是診斷威爾遜氏變性金標準,由於難以普遍接受肝穿刺,不能作為常規檢查,生化檢查不能確診的病例測定肝銅量是必要的,正常肝銅含量50μg/g乾重,WD患者多為250μg以上/g乾重,雜合子及肝病患者肝銅含量雖可增高,但不超過250μg/g乾重,穿刺肝組織恰為新生肝硬化結節可出現假陰性。
正常含量為15~55μg/g乾重,未經治療的Wilson病達250~3000μg/g乾重,<250μg/g乾重者可除外Wilson病。但是原發性膽汁性肝硬化、原發性硬化性膽管炎、肝外膽管阻塞、膽管閉鎖、肝內膽汁淤積或其他膽道疾病均可致肝銅增高,因而肝銅增高本身對Wilson病診斷價值不大。
④離體培養皮膚成纖維細胞銅含量測定
最早由Chan等(1980)報導,國內陳嶸等(1994)建立穩定的離體培養皮膚成纖維細胞模型,對威爾遜氏變性患者、雜合子及正常人皮膚成纖維細胞離體傳代培養,經高濃度銅孵育後威爾遜氏變性者胞漿內銅/蛋白比值遠高於雜合子組及正常對照組,二者完全無重疊,可確診不典型病例。
⑤放射性銅測定
在診斷困難的情況下,如Wilson病銅藍蛋白正常,雜合子有基因缺陷,其他疾病伴隨因而有K-F環,肝、尿銅都增加,而又不充許肝穿刺活檢時,可用此試驗。口服“Cu 2mg,於1、2、4、24、48h,測血清核素活力,正常人口服後1~2h出現高數,以後下降,隨後用64Cu參與銅藍蛋白合成而釋放至血液,在48h內緩慢上升,Wilson病時,起始1~2h出現高峰,但下降後,64Cu很少或根本不能參與銅藍蛋白合成,因而血清放射活性不再加升。
口服或靜脈注射64Cu或67Cu後,示蹤觀察它與銅藍蛋白動力學變化,健康人放射性銅進入血液與血漿蛋白結合,出現第一次血濃度高峰,放射性銅進入肝臟並與肝銅蛋白(包括Apo-CP)結合,血漿放射性銅濃度下降,帶放射性銅的肝銅蛋白釋放入血出現第二次血濃度高峰;患者可出現四種異常:肝臟攝取銅障礙使第一次放射性血銅濃度高峰延長;放射性銅與CP結合障礙不出現第二次濃度高峰;膽道排銅障礙使糞便中放射性銅排泄減少而尿中排泄增加;放射性銅在體內轉換延長。
肝腎功能檢查
某些威爾遜氏變性患者早期可無肝功能異常,肝損害可出現不同程度肝功能異常如血清總蛋白降低、γ-球蛋白增高等;腎功能損害可出現血清尿素氮及肌酐增高、尿蛋白等。
輔助檢查
骨關節X線檢查
約96%威爾遜氏變性患者骨關節X線異常,雙腕關節最常受損,表現骨質疏鬆、骨關節炎、骨軟化、關節周圍或關節內鈣化、自發性骨折和脊椎骨軟骨炎等。
神經影像學檢查
CT異常率約85%,CT顯示雙側豆狀核對稱性低密度區有診斷價值,常見側腦室和第Ⅲ腦室輕度擴大、大腦和小腦溝回變寬、腦幹萎縮,紅核及齒狀核低密度。治療後影像學無改變。MRI可見雙側豆狀核對稱性受累,T2W呈同心板層型增強,黑質緻密帶、大腦導水管周圍灰質及大腦腳高信號,丘腦較少受累。
腦電圖檢查
約50%的威爾遜氏變性患者出現異常,EEG改變多與病變嚴重程度一致,青黴胺及二巰基丙醇治療後EEG可改善。
誘發電位檢查
可證實本病感覺系統亞臨床損害,腦幹聽覺誘發電位(BAEP)異常率最高,各波潛伏期和波峰間期延長;視覺誘發電位(VEP)表現N1、N2、P1波PL延長;體感誘發電位(SEP)也有改變。
正電子發射斷層掃描(PET)
威爾遜氏變性患者可顯示腦局部葡萄糖代謝率(rCMRG)降低,豆狀核明顯。rCMRG改變可早於CT改變,對威爾遜氏變性早期診斷頗有價值。
基因診斷
威爾遜氏變性患者及家系成員常規生化檢測發現,在患者、雜合子與正常人間存在10%~25%的重疊數據,影響檢測特異性。基因診斷對症狀前診斷及雜合子檢出具有優越性。
①限制性片段長度多態性(RFLP)連鎖分析:Figus等(1989)首次套用RFLP對17個家系未患病個體進行基因檢測,國內外學者用此法對許多威爾遜氏變性家系進行連鎖分析,檢出不少症狀前患者及表型正常雜合子或病理基因攜帶者;
②微衛星標記分析:1993年國外已克隆了威爾遜氏變性的cDNA片段,獲得威爾遜氏變性基因附近幾個微衛星標記,Thomas用幾個新的微衛星DNA對威爾遜氏變性患者家系分析,提出單倍型有助於威爾遜氏變性家系鑑定及其他成員診斷;
③半巢式PCR-酶切分析:直接檢測威爾遜氏變性患者14號染色體外顯子His1069GLn基因突變;
④MspI酶切法:馬少春等(1998)研究發現,中國威爾遜氏變性患者中8號外顯子上778密碼子突變者占28.8%,是中國威爾遜氏變性患者高頻突變位點;
⑤螢光PCR法:黃帆等(1999)用螢光PCR技術,在58個威爾遜氏變性家系66例患者中診斷5例有Arg778Leu突變的純合子、21例雜合子,總檢出率為39.4%,較酶切法敏感。
診斷
對於兒童和青年的慢活肝、暴發性肝炎或肝硬化患者,須考慮除外威爾遜氏變性。K-F環、血銅藍蛋白、尿銅測定是必要的診斷步驟。肝組織活檢一是觀察組織變化,二是測銅含量,因而多有確診價值,必要時作64Cu結合試驗。另外,套用DNA限制性長度多態性連鎖分析對研究和發現雜合子,診斷Wilson病都有幫助。除外其他原因導致的肝硬化、慢性肝炎和暴發性肝炎
1.凡具下列情況應高度懷疑威爾遜氏變性患者,都必須行裂隙燈檢查有無角膜K-F環和銅代謝測檢。
(1)已證實威爾遜氏變性患者的同胞。
(2)同胞中有幼年死於急性重型肝炎(暴發性肝炎)或其他肝病(尤其病毒性肝炎血清抗原抗體陰性)者。
(3)兒童或少年發生原因不明的肝硬化、一過性黃疸、流涎、震顫、舞蹈樣運動或精神錯亂,均需注意與威爾遜氏變性鑑別,必要時,需進一步行裂隙燈和銅代謝檢查。
2.診斷標準
(1)家族遺傳史。父母是近親婚配、同胞有威爾遜氏變性患者或死於原因不明的肝病者。
(2)緩慢進行性震顫、肌僵直、構語障礙等錐體外系症狀、體徵及(或)肝症狀。
(3)肉眼或裂隙燈證實有K-F環。
(4)血清銅藍蛋藍蛋白<200mg/L。
(5)尿銅>50μg/24h。
(6)肝銅?250μg/g(乾重)。
判斷:凡完全具備上述(1)~(3)項或(2)及(4)項者,可確診為臨床顯性型。僅具有上述(3)~(5)項或(3)~(4)項者屬無症狀型威爾遜氏變性。僅有(1)、(2)項或(1)、(3)項者,應懷疑威爾遜氏變性。
鑑別診斷
威爾遜氏變性臨床表現複雜,患者無神經系統表現,出現各系統症狀時臨床誤診相當普遍,鑑別應從肝臟及神經系統兩方面考慮。
1.肝型威爾遜氏變性需與慢性活動性肝炎、慢性膽汁淤滯綜合徵或門靜脈性肝硬化等肝病鑑別。但肝病無血清銅減低、尿銅增高、血清銅藍蛋藍蛋白和銅氧化酶顯著降低等銅代謝異常,亦無角膜K-F環。
2.假性硬化型威爾遜氏變性需與帕金森病鑑別,威爾遜氏變性還需與特發性肌張力障礙鑑別。但帕金森病、特發性肌張力障礙均無銅代謝異常及角膜K-F環,可與威爾遜氏變性區別。
威爾遜氏變性的治療
常規治療方法
(1)改善飲用水質
國內《生活飲用水水質標準GB5749-85》對生活用水中的含銅量的要求是1mg/L。而成人每天平均需水量為2~3L。因此,開始驅銅治療的威爾遜氏變性患者應該食用去離子化或蒸餾水,以減少銅的攝入量。
(2)低銅飲食
開始治療的威爾遜氏變性患者應該避免食用含銅豐富的食物,例如動物肝臟、貝殼、螺類、可可、堅果仁、豆類、蘑菇、朱古力等,以減少銅的攝入,使每日銅攝入低於1.5mg。
藥物治療
(1)鋅製劑
①作用特點
鋅劑治療威爾遜氏變性的機理是:
A.鋅能競爭性地抑制銅在腸道吸收,使糞銅排出增加。
B.鋅能通過誘導腸和肝細胞合成金屬硫蛋白(metallothionein),後者與銅親和力高,使大部分銅呈非毒性結合狀態或隨腸黏膜細胞脫落排出體外。
C.鋅劑對肝和腦中過量的銅尚有解毒作用。
D.鋅劑誘導腸、肝細胞產生的金屬硫蛋白是一種潛在的羧自由基清除劑。鋅劑能較快緩解威爾遜氏變性臨床症狀,改善異常的生化指標和腦電圖,消除或減輕顱腦異常影像。鋅劑服用方便,副作用小,無致畸,價廉,藥源廣,是1980年以來臨床實踐已證實的治療威爾遜氏變性安全有效的藥物,已被推薦為威爾遜氏變性的起始和首選藥。
②副作用
A.對胃腸刺激,飯前服較大劑量硫酸鋅可出現噁心、嘔吐和腹瀉,飯後服可避免。
B.口唇異麻和燒灼感。
C.鋅劑可減少體內維生素C含量。
D.長期大劑量服用可產生高鋅影響免疫功能和鐵的利用,甚至損害學習記憶功能;鋅(銅)升高可使體內膽固醇代謝紊亂致動脈粥樣硬化,但目前尚未見長期用鋅劑治療的威爾遜氏變性病人出現上述高鋅副作用的報導。
③用法和劑量
A.硫酸鋅:最常用(片劑、膠囊和溶液)。成人,200~1200mg/d,空腹服可避免食物干擾鋅的吸收,而餐後服可減輕胃腸道反應,但應儘量避免影響鋅吸收的麵包、精纖維與含多量植物酸的食物;如與促進鋅吸收的肉類同用可提高鋅的療效。
B.醋酸鋅:消化道反應輕。成人,25mg/次,4次/d,23∶00加服50mg。
C.葡萄糖酸酸鋅和甘草鋅:極少有胃腸道副作用,排銅效果似硫酸鋅,更適於治療威爾遜氏變性。葡萄糖酸酸鋅片560mg/次,3次/d,飯後服。
(2)傳統驅銅金屬絡合劑
①青黴胺:1956年Walshe首先提出並成功地用於威爾遜氏變性,但治療初始6~8周可使症狀加重,臨床症狀改善較鋅劑慢。常有過敏(發熱、皮疹、淋巴結病變、血小板減小、白細胞降低、嚴重溶血性貧血甚至再障等)和引起自身免疫性疾病(免疫複合物性腎病、溶血性貧血、Goodpasture綜合徵、甲狀腺炎、紅斑狼瘡綜合徵、重症肌無力、多發性肌炎、視神經炎等),尚可使維生素B6缺乏,胎兒致畸。為此近年採用鋅劑取代,必要時可並用小劑量青黴胺,成人,1.0~3.0g/d,10歲以下0.5~0.75g/d;同時補充維生素B6(30~50mg/d)。
②二巰丙醇(二巰基丙醇):1948年Cuming提出BAL可通過增加尿銅排泄用於治療威爾遜氏變性。缺點是僅有針劑,注射部位疼痛,還有噁心、嘔吐和眩暈等副作用,且不易維持銅的負平衡,已被他藥取代。3~5mg/(kg·d),1~2次/d,連用7~10天,肌注;停藥1周,再重複7~10天;以後視病情需要每1~2周100~200mg,肌注。
③二巰丁二鈉(二巰基丁二酸鈉):副作用較少,但只能靜脈給藥。用生理鹽水配成5%~10%溶液1.0~2.0g/d,連用5~10天,緩慢靜注;可重複使用。近年可口服二巰基丁二酸膠囊,成人4.0g/d,兒童2.0g/d,4周為一療程。
④三乙烯四甲胺:系強金屬絡合劑,副作用小,價格貴。1.0g/次,2次/d,維持量400g/次,3次/d。
⑤二巰基丙磺酸鈉:療效不及青黴胺。50%二巰基丙磺酸鈉2.5ml/次,2次/d,連用5天,肌注,可重複使用。
⑥依地酸鈣鈉:也可選用,但療效較差。
(3)硫化鉀
使銅在腸道形成不溶性硫化銅排出體外,抑制銅吸收。20~40mg口服,3次/日。
(4)三乙基四胺(triethylene teramine)
成人1.2g/d,副作用小,用於青黴胺嚴重毒副反應患者,但藥源困難,價格昂貴。
手術治療
①威爾遜氏變性合併脾功能亢進,白細胞及血小板長期顯著減少,易發生出血和感染,脾切除是重要輔助治療措施,青黴胺也有降低白細胞及血小板副作用,這類患者宜小劑量或不用青黴胺。
②肝臟移植術,在威爾遜氏變性極為嚴重和用藥無效時可採用。部分患者術後臨床症狀及生化指標均獲恢復,並存活多年;但系非根治法,費用貴,推廣困難。對有明顯肝硬化或肝功能衰竭患者,原位肝移植可延長存活期。文獻報告2例威爾遜氏變性患者肝移植後,症狀改善,K-F環消失,生化指標恢復正常,術後分別存活6年和4年。目前國內威爾遜氏變性患者肝移植最長存活時間為500天。
基因診斷與治療
威爾遜氏變性的基因已克隆,定位於13號染色體,突變方式為顛換、轉換、缺失和插入,表達產物為P型ATP酶。目前為獲得準確快速的基因診斷方法,正套用聚合酶鏈反應-單鏈構象多態(PCR-SSCP)和PCR-DNA測序法檢測HLG基因外顯子的突變和多態,從而為基因治療奠定基礎。
其他有骨骼脫鈣者
補充維生素D、鈣劑。對於上消化道出血、食管胃底靜脈曲張、腹水等治療,同其他原因所致的相同病變。
對症治療
肌強直和震顫可用安坦或金剛烷胺,症狀明顯可用複方L-dopa;精神症狀明顯可用抗精神病藥,抑鬱症狀明顯可用抗抑鬱藥,智力減退可用促智藥。無論有無肝損害,均需護肝治療,可用肝泰樂、肌苷及維生素C等。
中醫治療
中醫認為威爾遜氏變性屬肝陰不足,肝風內動,可用肝豆片1號及肝豆湯,由大黃、黃連、薑黃、金錢草、澤瀉和三七等組成,中藥能促進膽汁、尿及糞的排銅,較安全,但排銅作用不如青黴胺及鋅劑等,單獨使用常不能達到滿意療效。
療效評價
(1)臨床症狀、體徵消失。
(2)臨床症狀好轉、體徵改善,應繼續治療。
(3)臨床症狀未愈、體徵無變化。
預後
威爾遜氏變性如不及時進行積極治療,病情多數持續進行,至晚期則因嚴重肝硬化、肝功能衰竭或並發感染而死亡。病程長短與起病年齡有密切關係,進展多數緩慢,病程可延續數年甚至三四十年,平均病程為4~5年,但持續十多年者並非少見。
在1948年以前,威爾遜氏變性因無有效療法,病程多不超過3~4年,自從套用化學療法以來,預後頗有改觀。經化學療法後,神經症狀可有一定程度的好轉,但亦可復發。有些症狀可完全緩解一段時間。治療以前神經症狀存在越久者,恢復的程度就越差。有些神經症狀,在治療連續進行2年以上仍可繼續好轉,但肝臟損害恢復較差。
威爾遜氏變性的預後主要取決於治療的早晚、發現本病時肝臟的情況以及肝臟疾病進展的快慢。有些患者可早期死於急性肝壞死。亦有人認為神經症狀出現越早者病情進展越快。另有人提出少年型的藥物療效比成年人差,曾報告一組10例少年型病例,平均病程為5~7年。威爾遜氏變性如能及早治療,症狀(特別是神經症狀)可能停止發展或獲得緩解。因此對於患者的同胞兄弟在出現症狀之前,應從早進行檢查,治療越早,預後將越佳。今後對於代謝障礙各個環節如能更進一步了解,則療效必將進一步提高。
威爾遜氏變性的預防
防治威爾遜氏變性應及早確診,及時糾正患者銅代謝的正平衡狀況。注意減少食物含銅量(<1mg/d),限制含銅多的飲食,如堅果類、朱古力、豌豆、蠶豆、玉米、香菇、貝殼和螺類、蜜糖、動物肝和血等。高胺基酸、高蛋白飲食能促進尿銅排泄。
對威爾遜氏變性患者的家族成員測定血清銅藍蛋藍蛋白、血清銅、尿銅及體外培養皮膚成纖維細胞的含銅量有助於發現威爾遜氏變性症狀前純合子及雜合子,發現症狀前純合子可以及早治療。雜合子應禁忌與雜合子結婚以免其子代發生純合子。產前檢查如發現為純合子,應終止妊娠,以杜絕患者的來源。
相關藥品
氧、細胞色素C、谷氨酸、多種胺基酸、青黴胺、尿素、葡萄糖、青黴素、醋酸、硫酸鋅、葡萄糖酸鋅、甘草鋅、金剛烷胺、肌苷、維生素C、大黃、二巰丙醇、二巰丁二鈉、依地酸鈣鈉、潑尼松
相關檢查
銅藍蛋白、血清銅、蛋白C、尿銅、組氨酸、谷氨酸、絲氨酸、血清總蛋白、血清尿素、尿素氮、維生素B6、維生素C