分子中含有兩個或兩個以上的原子,稱為多原子分子 。比如Ne叫單原子分子,而H2或H2O就叫多原子分子,其中含有兩個原子的分子是雙原子分子。
基本介紹
- 中文名:多原子分子
- 外文名: polyatomic molecule
- 對比:單原子分子
空間構型
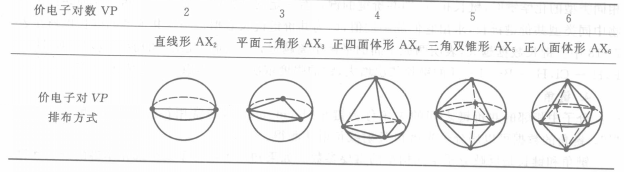 中心原子價電子對排布方式
中心原子價電子對排布方式極性判斷
鍵的極性
分子構型
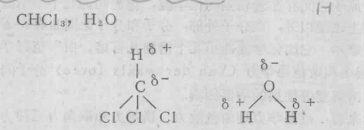 分子構型
分子構型分子中含有兩個或兩個以上的原子,稱為多原子分子 。比如Ne叫單原子分子,而H2或H2O就叫多原子分子,其中含有兩個原子的分子是雙原子分子。
 中心原子價電子對排布方式
中心原子價電子對排布方式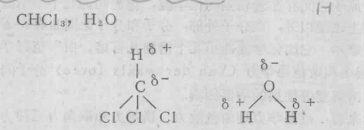 分子構型
分子構型分子中含有兩個或兩個以上的原子,稱為多原子分子 。比如Ne叫單原子分子,而H2或H2O就叫多原子分子,其中含有兩個原子的分子是雙原子分子。...
它的每一個原子看作為一個分子,與雙原子分子以及多原子分子不同的是,它的化學性質直接由原子保持。單原子分子單原子與原子 編輯 ...
《多原子分子的結構及振動光譜(重排本)》是2014年12月出版的圖書,作者是吳大猷。...... 《多原子分子的結構及振動光譜(重排本)》是2014年12月出版的圖書,作者...
分子自由度是物體運動方程中可以寫成的獨立坐標數,單原子分子有3個自由度,雙原子,三原子不考慮振動相當於剛體,分別有5個(3平2轉)、6個自由度(3平3轉),考慮...
一種帶電的共價鍵原子群。多原子離子要么有多餘的電子(負離子),要么是電子(正離子)的短缺。非分子。 ...
分子是由組成的原子按照一定的鍵合順序和空間排列而結合在一起的整體,這種鍵合順序和空間排列關係稱為分子結構。由於分子內原子間的相互作用,分子的物理和化學性質...
原子與分子物理是物理學中最重要的二級學科之一。它是研究原子分子結構、性質、相互作用、運動規律及其與周圍環境相互作用的一門科學。原子與分子物理學是一門基礎...
《多原子分子振動譜研究》是一部理論物理學類型的學術性論文,作者是謝汨。...... 《多原子分子振動譜研究》是一部理論物理學類型的學術性論文,作者是謝汨。...
電子象雲(電子云)一樣分布在原子核周圍的空間,因為它是按幾率分布的,所以電子云具有不同的形狀和伸展方向。分子是原子的結合體。...
它的要點是:從分子的整體性來討論分子的結構,認為原子形成分子後,電子不再屬於個別的原子軌道,而是屬於整個分子的分子軌道,分子軌道是多中心的;分子軌道由原子軌道...
分子中正負電荷中心不重合,從整個分子來看,電荷的分布是不均勻的,不對稱的,這樣的分子為極性分子,以極性鍵結合的雙原子分子一定為極性分子,極性鍵結合的多原子分子...
原子與分子物理學科多年來緊密圍繞國家需求和學科前沿。...... 原子與分子物理學科多年來緊密圍繞國家需求和學科前沿,在原子分子結構、光譜和碰撞理論,原子分子激發態...
由分子構成的物質,分子是保持物質化學性質的最小粒子。原子是化學變化中的最小粒子。 分子與原子 都是構成物質的一種粒子,質量和體積都非常小,彼此間有間隔,在不...
單質的分子是由同種原子構成的;化合物的分子是由幾種不同的原子構成的。在上述例子中,氫的分子是由兩個氫原子構成的,氧的分子是由兩個氧原子構成的,而水的...
在1860年以前的近半個世紀裡,由於不承認分子是單質或化合物在游離狀態下獨立存在的最小質點,不承認分子是由原子組成的這一正確假說,世界各國化學家們對原子和分子...
原子與分子物理學科多年來緊密圍繞國家需求和學科前沿,在原子分子結構、光譜和碰撞理論,原子分子激發態動力學,原子分子雷射光譜等方面形成了穩定的研究方向,並開拓了...
因此國際上規定採用相對原子質量和相對分子質量來表示原子、分子的質量關係。相對分子質量在數值上等於摩爾質量,但單位不同。相對分子質量的單位是“1” ,而摩爾質量...
原子分子論,一種關於物質結構的學說。淵源於古代。19世紀初,英國化學家J·道爾頓與義大利化學家A·阿伏伽德羅在研究總結了化學變化的許多重要規律的基礎上,提出了...
