相律
將相律套用於單組分體系,這時相律的一般表達式為:ƒ=1-Φ+2=3-Φ。由上式可見ƒ=0時Φ=3,單組分體系最多只能有三個相平衡共存;當Φ=1時,ƒ=2;最多有兩個獨立變數,即溫度和壓力;所以單組分體系可以用P-T平面圖來全面描述體系的相平衡關係。
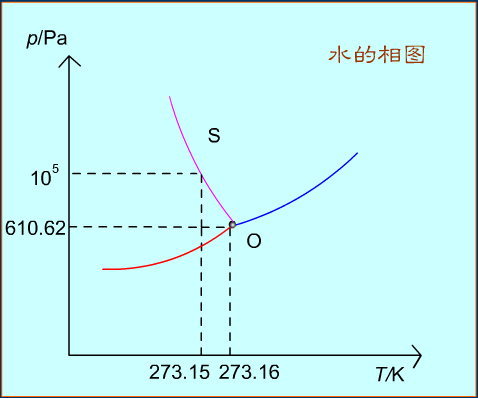
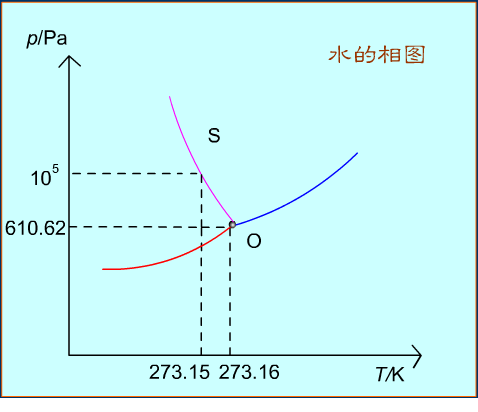
水的相圖
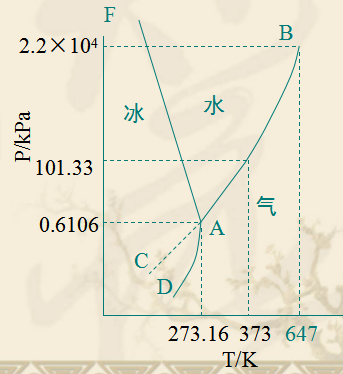
現選用常見的水為例結合相律來討論水的狀態圖。水在一般溫度和壓力下有三種聚集狀態:水蒸氣(氣態)、水(液態)、冰(固態)。右圖是根據實驗數據繪製的水的相圖(示意圖)。
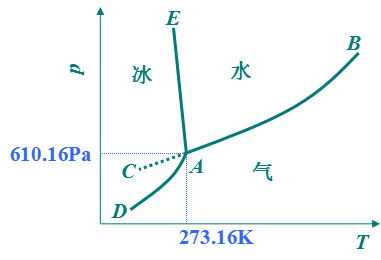
AB是氣-液兩相平衡線,即水的蒸氣壓曲線。它不能任意延長,終止於臨界點B。臨界點p=2.2X107Pa,T=647K,這時氣-液界面消失。高於臨界溫度,為超臨界流體,不能用加壓的方法使氣體液化。
AD是氣-固兩相平衡線,即凍的升華曲線,理論上可延長至0K附近。
AE是液-固兩相平衡線,斜率為負,要使冰降低熔點,必須增加壓力。
當AE延長至壓力大於p=2.0265 X108Pa時,相圖變得複雜,有6種不同結構的冰生成。
AC是BA的延長線,是過冷水和水蒸氣的介穩平衡線。因為在相同溫度下,過冷水的蒸氣壓大於凍的蒸氣壓,所以AC線在AD線之上,化學勢大,過冷水處於不穩定狀態,一旦有凝聚中心出現(加少許冰),就立即全部變成冰。
A點是三相點(triple point),氣-液-固三相共存,Φ=3,f=0。三相點的溫度和壓力皆由系統自定。氣-液-固化學勢相等。
三相點是物質自身的特性,不能加以改變,如H2O的三相點T=273.16K,p=610.62Pa。
兩相平衡線上的相變過程
在兩相平衡線上的任何一點都可能有三種情況。
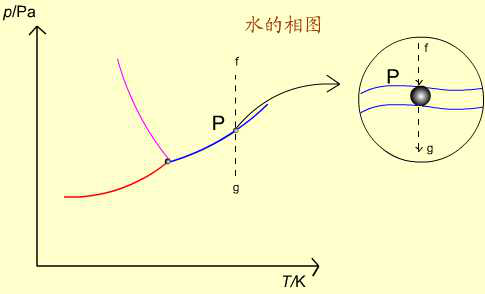
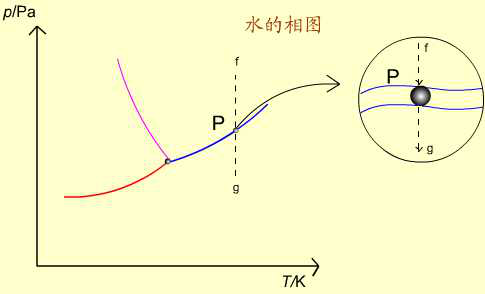
如AB線上的P點:
(1)處於P點的純水,保持溫度不變,逐步減小壓力,在無限接近於P點之前,氣相尚未形成,系統自由度為2。用升壓或降溫的辦法保持液相不變。
(2)到達P點時,氣相出現,在氣-液兩相平衡時,f=1。壓力與溫度只有一個可變。
(3)繼續降壓,離開P點時,最後液滴消失,成單一氣相,f=2。通常只考慮(2)的情況。
三相點與冰點的區別
三相點是物質自身的特性,不能加以改變,如H2O的三相點T=273.16K,p=610.62Pa。
冰點是在大氣壓力下,水、冰、氣三相共存。當大氣壓力為100kPa時,冰點溫度為273.15K,改變外壓,冰點也隨之改變。
冰點溫度比三相點溫度低0.01k是由兩種因素造成的:
(1)因外壓增加,使凝固點下降0.00748k;
(2)因水中溶有空氣,使凝固點下降0.00241k。
二氧化碳超臨界萃取技術
優點與弊端:
1 利用超臨界CO2萃取技術提取中草藥有效成分,沒有殘留的有機溶劑,故產品為純天然的,可節能大量溶劑。 2.可以在低溫下提取,特別適合於那些含有對濕熱不穩定易氧化物質的中草藥的萃取。
3.超臨界CO2萃取速度快,可以縮短生產周期。
4.超臨界CO2萃取,可提高收率,降低成本。
局限性:
1.對於極性大,分子量超過500的物質的萃取,需加夾帶劑或在很高的壓力下進行,這就需選擇合適的夾帶劑或增加高壓設備。
2.中草藥中成分往往複雜,近似化合物多,單獨採用SFE-CO2萃取技術往往滿足不了純度的要求,要與其他分離手段聯用,如與色譜柱聯用、或和精餾分離手段聯用。