基本介紹
- 中文名:取向力
- 外文名:dipole-dipole attraction, dipole-dipole force
- 本質:靜電引力
- 相關學科:物理、化學
簡介,定義,影響因素,范德華力,
簡介
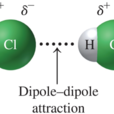
取向力只有極性分子與極性分子之間才存在。取向力的本質是靜電引力,其大小決定於極性分子的偶極矩。分子的極性越強,偶極矩越大,取向力越大。如:HI 、HBr 、HCl 的偶極矩依次增大,因而其取向力依次增大。此外,取向力還受溫度的影響,溫度越高,取向力越弱。
對大多數極性分子,取向力僅占其范德華力構成中的很小分額,只有少數強極性分子例外。
定義
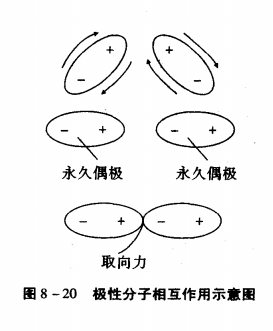
極性分子的正、負電荷中心不重合,分子中存在永久偶極。極性
分子相互接近時,極性分子 的永久偶極間同極相斥、異極相吸,
— 個分子的帶負電的一端和另一個分子帶正電的一端接近,使極
性分子按一定方向排列。這種由 於取向而在極性分子的永久偶極間
產生的靜電作用力稱為取向力。
影響因素
取向力的本質是靜電作用, 取向力的大小與極性分子的偶極矩及分子間的 距離有關。
(1)分子的偶極矩越大,取向力就越大;如:HI 、HBr 、HCl 的偶極矩依次增大,因而其取向力依次增大。
(2)分子間的距離越大,取向力將減弱。
(3)此外,當溫度升高時,取向力會減少。因為溫度升高時,分子的熱運動加劇,破壞了分子的有序排列,減少了取向的趨勢。
范德華力
可以分為三種作用力:誘導力、色散力和取向力。又稱分子間作用力,是存在於中性分子或原子之間的一種弱鹼性的電性吸引力。分子間作用力(范德瓦爾斯力)有三個來源:①極性分子的永久偶極矩之間的相互作用。②一個極性分子使另一個分子極化,產生誘導偶極矩並相互吸引。③分子中電子的運動產生瞬時偶極矩,它使臨近分子瞬時極化,後者又反過來增強原來分子的瞬時偶極矩;這種相互耦合產生淨的吸引作用,這三種力的貢獻不同,通常第三種作用的貢獻最大。它們之間的關係如下:
極性分子與極性分子之間,取向力、誘導力、色散力都存在;極性分子與非極性分子之間,則存在誘導力和色散力;非極性分子與非極性分子之間,則只存在色散力。這三種類型的力的比例大小,決定於相互作用分子的極性和變形性。極性越大,取向力的作用越重要;變形性越大,色散力就越重要;誘導力則與這兩種因素都有關。但對大多數分子來說,色散力是主要的。實驗證明,對大多數分子來說,色散力是主要的;只有偶極矩很大的分子(如水),取向力才是主要的;而誘導力通常是很小的。極化率α反映分子中的電子云是否容易變形。雖然范德華力只有0.4—4.0kJ/mol,但是在大量大分子間的相互作用則會變得十分穩固。比如C—H 在苯中范德華力有7 kJ/mol,而在溶菌酶和糖結合底物范德華力卻有60kJ/mol,范德華力具有加和性。