定義
反義RNA是指與mRNA互補的RNA分子,也包括與其它RNA互補的RNA分子。由於
核糖體不能翻譯
雙鏈的RNA,所以反義RNA與mRNA特異性的互補結合, 即抑制了該mRNA的翻譯。通過反義RNA控制mRNA的翻譯是
原核生物基因表達調控的一種方式,最早是在E.coli 的產腸桿菌素的Col E1
質粒中發現的,許多實驗證明在
真核生物中也存在反義RNA。近幾年來通過人工合成反義RNA的
基因, 並將其導入細胞內
轉錄成反義RNA,即能抑制某特定基因的表達,阻斷該基因的功能,有助於了解該基因對
細胞生長和分化的作用。同時也暗示了該方法對腫瘤實施
基因治療的可能性。
 反義RNA
反義RNA來源
細胞中反義RNA的來源有兩種途徑:第一是
反向轉錄的產物,在多數情況下, 反義RNA是特定
靶基因互補鏈反向轉錄產物, 即產生mRNA和反義RNA的DNA是同一區段的互補鏈。第二種來源是不同基因產物,如OMPF基因是大腸桿菌的
膜蛋白基因,與透性有關,其
反義基因MICFZE則為另一基因。
作用機制
反義RNA的分類和作用機制:下表總結了
原核細胞內天然存在的11種反義RNA。這些反義RNA按其作用機制可經分為三大類。
調節水平 反義RNA 靶RNA 分類 功能 來源
轉錄後水平 micF RNA ompF mRNA 1A OmpF合成 染色體
oop RNA cⅡmRNA 1B 溶菌-溶源
噬菌體sar RNA antmRNA 1A 溶菌-溶源 噬菌體
ouT RNA 轉位酶mRNA ⅠA 轉位作用
轉位子finp RNA traJ mRNA ⅠA DNA轉位
sok RNA hok mRNA ⅠA 殺死作用
copA RNA repA mRNA Ⅱ 複製
質粒R1162RNA repⅠmRNA Ⅱ 複製
pT181RNA repC mRNA Ⅱ 複製
轉錄水平 ticRNA CAP mRNA Ⅲ cAMP結合蛋白 染色體
複製前水平 RNAⅠ RNAⅡ Ⅲ DNA複製 質粒
Ⅰ類:這類反義RNA直接作用於其靶mRNA的
SD序列和/或
編碼區,引起翻譯的直接抑制(ⅠA類)或與靶mRNA結合後引起該
雙鏈RNA分子對
RNA酶Ⅲ的敏感性增加,使其降解(ⅠB類)。Ⅱ類:這類反義RNA與mRNA的SD序列的上游
非編碼區結合,從而抑制靶mRNA的翻譯功能。其作用機制尚不完全清楚,可能是反義RNA與靶mRNA的上游序列結合後會引起
核糖體結合位點區域的
二級結構發生改變,因而阻止了
核糖體的結合。Ⅲ類:這類反義RNA可直接抑制靶mRNA的
轉錄。
ticRNA(transcription inhibitory complementary RNA)是大腸桿菌中CAP蛋白(cAMP結合蛋白)的mRNA的反義RNA。ticRNA的
基因的
啟動子可被cAMP-CAP複合物所激活,從CAP mRNA的
轉錄起始位點上游3個核苷酸處開始,以CAP mRNA的模板DNA鏈的
互補鏈為模板,合成ticRNA。ticRNA具體長度不清楚,但是它是5'端一段正好和CAP mRNA的5'端有不完全的互補,可以形成雙鏈的RNA
雜交體。而在CAP mRNA上緊隨雜交區之後的是一段約長11bp的A,U豐富區。這樣的結構十分類似於ρ不依賴性的轉錄
終止子的結構,從而CAP mRNA的
轉錄剛剛開始不久後即迅速終止。從這個例子中我們可以看到CAP蛋白合成的
自我調節作用。當CAP合成達一定量後,即可與cAMP結合成cAMP-CAP複合物。再激活
ticRNA的
啟動子轉錄出ticRNA,反過來抑制CAP-mRNA的合成。
功能
調控細菌基因的表達
反義RNA對編碼CAP的
基因的調控作用已如前述。這裡再介紹一下micF RNA對ompF基因的表達的調控。ompF蛋白質是大腸桿菌的
外膜蛋白的主要成分這一。micF RNA是從另一基因(ompC基因)附近的
DNA序列轉錄而來,和o-mpFn RNA的5'端有70%的序列互補,因此在體外micF RNA可以抑制ompF mRNA的翻譯。但是這種抑制作用在體內是否重要尚有疑問,因為缺失micF基因的菌株其ompF蛋白的表達只受到輕微的影響。
噬菌體溶菌/溶源狀態的控制
反義RNA也參與了λ和P22
噬菌體的溶菌/溶源狀態的控制。P22噬菌體編碼一種抗
阻遏蛋白Ant,它可以抑制許多λ樣噬菌體的阻遏蛋白與DNA的結合。這對於剛剛感染細胞的P22建立λ樣
原噬菌體(
prophage)是有益的。但是Ant必須在嚴格的控制下,否則Ant的過分表達必將阻止溶源狀態的建立,而成為溶菌性的噬菌體。Ant蛋白質表達的控制是利用反義RNA(sarRNA)能與ant mRNA的翻譯起源區互補結合,從而抑制ant mRNA翻譯成Ant蛋白。
在
λ噬菌體中cⅡ蛋白控制著溶菌或溶源狀態的選擇。cⅡ蛋白可以激活λPre
啟動子,該啟動子控制的基因是λ噬菌體
整合作用所必須的,且同時能抑制λ噬菌體的複製。cⅡ蛋白的另一功能是延緩λ
晚期基因的表達,其作用機制是cⅡ蛋白激活PaQ的啟動子,
轉錄出PaQRNA。PaQRA是編碼Q蛋白的mRNA的反義RNA。因此,PaQRNA能與QmRNA配對雜交而抑制其翻譯,而Q蛋白早已知道是晚期
基因表達的
激活蛋白。
cⅡ基因本身的表達還受到稱為oopRNA的反義RNA的調控。oopRNA與cⅡ基因的3'端互補,但其具體作用機制尚不清楚。
IS10轉位作用的抑制
outRNA是一種反義RNA,可以和IS10編碼的轉位酶mRNA(INRNA)5'端結合而抑制其翻譯,當細胞內只有一個考貝IS10時,只能生成很少量的outRNA,故轉位酶仍可生成。但當IS10的考貝數增多時,outRNA愈來愈多,其控制作用亦明顯增強,所以稱為多考貝抑制現象。這種現象可以防止IS10的過量堆積引起的細胞損害。
人工合成
既然反義RNA在
原核生物中對
基因表達起著重要的調控作用,那么人工設計在天然狀態下不存在的反義RNA來調節
靶基因的表達,想必也是可能的。這已在不少實驗中得到證實。
1.由於目前對靶mRNA的
SD序列的上游區的結構了解甚少,因此,在要設計Ⅱ類反義RNA用於和靶mRNASD序列上游區結合,以期達到調節該mRNA翻譯的目的是比較困難的。
2.Ⅲ類反義RNA是和mRNA的起始處結合而形成類似ρ-不依賴性的
轉錄終止子而使
轉錄水平上抑制靶基因的表達。因此,要設法在靶mRNA上找到一段連續的U序列,就可以設計出反義RNA,與該U序列上游的mRNA鏈互補,以形成ρ-不依賴性
終止子。理想的作用位點是在靶mRNA的5'端上游的
非編碼區,以免受
核糖體的影響。
3.只要
靶基因的
核苷酸順序已經知道,就可以人工設計出Ⅰ類反義RNA。有時還可設計同時具有Ⅰ類和Ⅲ類反義RNA功能的反義RNA。
我們還可以設計出天然存在的反義RNA的反義RNA來。這樣就可以
拮抗原始反義RNA對靶mRNA的抑制作用。而達到激活或加強某個靶基因的表達的目的。然而並不是所有的mRNA對其相應的Ⅰ類反義RNA都敏感。例如,有的mRNA壽命很短,只有1-2分鐘,它們和反義RNA結合的機會較少,因而就較不敏感。反之,另一些mRNA則很穩定,壽命可達十多分種,則其對相應的反義RNA的抑制作用就很敏感。此外,反義RNA本身的穩定性有很大的實際意義。顯然,穩定的反義RNA對靶mRNA的調節作用比不穩定的反義RNA要好。
反義RNA技術
反義DNA是指一段能與特定的DNA或RNA以
鹼基互補配對的方式結合,並阻止其
轉錄和翻譯的短核酸片段,主要指
反義寡核苷酸,因更具藥用價值而倍受重視。
核酶(ribozyme)是具有酶活性的RNA,主要參加RNA的加工與成熟。天然核酶可分為四類:(1)
異體催化剪下型,如RNaseP;(2)自體催化的剪下型,如植物類病毒、
擬病毒和衛星RNA;(3)第一組
內含子自我剪接型,如
四膜蟲大核26SrRNA;(4)第二組內含子自我剪接型。利用
反義技術研製的藥物稱
反義藥物。反義藥物作用於產生蛋白的
基因,因此可廣泛套用於多種疾病的治療,如傳染病、炎症、心血管疾病及腫瘤等。與傳統藥物比較反義藥物更具選擇性及效率,因此也更高效低毒。基於上述特點反義藥物已成為藥物研究和開發的熱點。而且反義技術還可以套用於生物科學的基礎研究。
注意要點
[1]長的反義RNA並不一定比短的反義RNA更為有效;
[3]在真核生物中,對應於5'端非
編碼區的反義RNA可能比針對編碼區的反義RNA更有效;
[4]儘量避免在反義RNA分子中出現自我互補的
二級結構;
[5]設計的反義RNA分子中不應有AUG或開放讀框,否則該反義RNA亦會與
核糖體結合而影響其與靶mRNA的配對結合;
[6]進一步還可以將帶有ribozyme結構的RNA連在反義RNA的3'端尾上,當反義RNA與靶mRNA雜交後,即可利用其酶活性來降解靶mRNA。
此外,為了增強反義RNA的作用,還可以採取一些額外措施,例如:[1]由於反義RNA對靶mRNA的抑制作用有劑量依賴性,所以在構建反義RNA基因時,要選擇強的、可以誘導的
啟動子以增強反義RNA本身的表達;
[2]構建許多個反義RNA
基因串連在一起,以得到線性重複的
多拷貝基因,對提高反義RNA的表達也有利;[3]
RNA酶Ⅲ可以降解RNA:RNA
雜交體,所以在構建反義RNA基因時,可將RNA酶Ⅲ的基因也同時轉化到
靶細胞中並進行表達。這樣,當反義RNA與靶mRNA結合後,RNA酶Ⅲ即可將其降解。這顯然有利於反義RNA的抑制作用;
近年來,有關反義RNA的研究進展迅速,已經套用到抗病毒感染,研究
癌基因的作用機制,探索腫瘤治療的可行途徑等方面。在今後一段時間內,有關反義RNA的研究肯定將會有更加迅速的進展和更廣闊的套用前景。
穩定方法
[1]反義RNA3'端帶有
莖環結構或類似ρ-不依賴性
終止子結構時,可以穩定RNA分子;
[2]Gorski等還發現在
T4噬菌體的
基因32mRNA的5'端上游的莖環結構及其附近的序列亦可穩定RNA分子。所以在設計反義RNA基因時,最好將產生3'及5'端這種
二級結構的序列克隆在反義RNA基因的兩端。Hirashima等1986年發現,針對靶mRNA的
SD序列和AUG區域的反義RNA,要比單純對編碼區域的反義RNA更為有效。1989年Hirashima又發現,針對SD序列和它的上游區域(但不包括AUG)的反義RNA更為有效。在真核生物中,針對5'端
非編碼區的反義RNA更有效。但也有實驗表明針對第一
內含子的反義RNA也同樣有效。
 反義RNA
反義RNA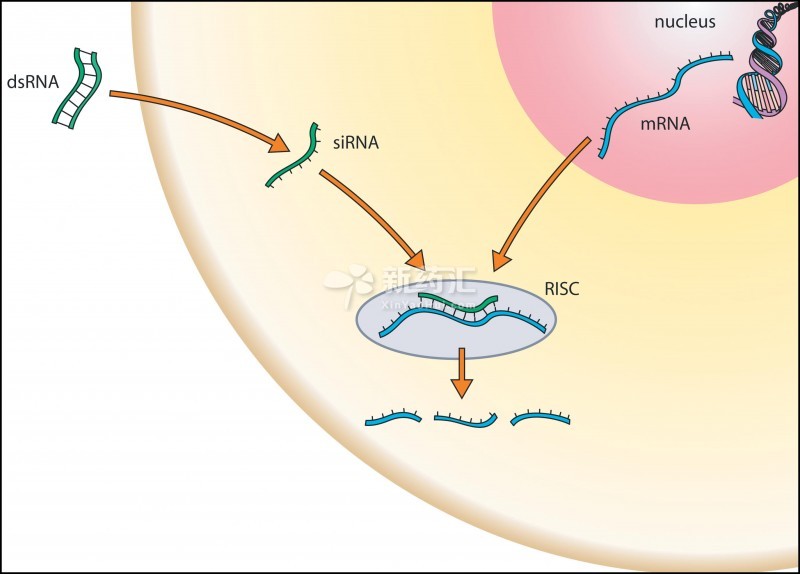
 反義RNA
反義RNA