貝類毒素的一種,屬於原多甲藻酸(Azaspir acids)組。1996年2月被首次分離出,生物起源尚無明確定論。為脂溶性聚醚化合物。毒性比較穩定,常規的烹飪和加工處理無法去除。檢測方法為小鼠生物測定法和高效液相色譜法。
基本介紹
- 中文名:原多甲藻酸貝類毒素
- 外文名:Azaspir acid
- 化合物分類:脂溶性聚醚
- 所屬學科:海洋科技
- 存在部位:貝類全部組織
簡介,化學結構及性質,毒性,毒理,檢測方法,
簡介
原多甲藻酸貝類毒素(Azaspir acid)最初是因為在1995年11月荷蘭人因吃了在愛爾蘭Killary港養殖的紫貽貝(Mytilusedulis)而發生了中毒事件而受到關注。1996年2月,Yasumoto等從采自Killary港的紫貽貝中分離得到了Azaspiracid(簡稱AZA1)及兩種類似物AZA2和AZA3。因此,以前曾把它稱之為Killary toxin-3(KT-3)。由於AZA(AZA1及其類似物的統稱)和腹瀉性貝毒(DSP)引起的人體中毒症狀極其相似,一些學者最初把AZA當作腹瀉性貝毒的新成員。後來發現AZA具有獨特的化學結構和特性,與人們早已熟知的麻痹性貝毒(PSP)、腹瀉性貝毒(DSP)、神經性貝毒(NSP)、失憶性貝毒(ASP)和西加毒素(CFP)有著明顯的區別,因此把由AZA引起的人員中毒事件稱為Azaspiracid shellfish poisoning(AZP)。FAO/IOC/WHO在2004年3月都柏林(Dublin)貝類生物毒素會議以化學結構將貝類生物毒素分為8組的分類方法,AZA1屬於原多甲藻酸(Azaspir acids)組。
AZA的生物起源還沒有明確定論。據報導,原多甲藻屬(Protoperidinium)的某些種類能夠產生AZA。原多甲藻屬在分類學上隸屬於甲藻門(Dinophyta)、橫裂甲藻綱(Dinophyceae)、多甲藻目(Peridiniales)、多甲藻科(Peridiniaceae),有記錄的種類達60多種。從厚甲原多甲藻(P. crassipes)細胞中提取出了AZA1、AZA2和AZA3三種成分,並測得AZA的平均含量為1.8×10-15mol/cel,其中,AZA1占總量的82%。這表明,厚甲原多甲藻可產生AZA。其它浮游植物是否也能產生AZA有待於進一步研究。
化學結構及性質
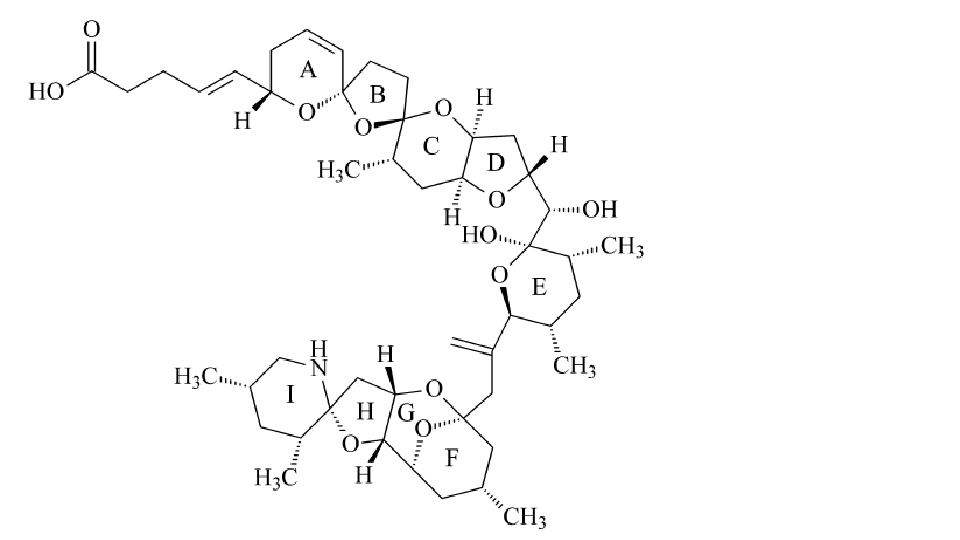
採用高解析度快原子轟擊質譜(FAB-MS)、二維核磁共振(2D-NMR)和碰撞誘導裂解(CID)-串聯質譜(MS/MS)技術測定了AZA的結構。AZA毒素在結構上與其他毒素顯著不同,是一類脂溶性聚醚化合物,無色非晶質固體,含有螺環的含氮聚醚,末端含有羧基。其碳骨架由40個碳原子組成,分子中有20個立體異構中心和9個環。迄今為止,研究人員已從染毒的貝類組織中分離得到了11種毒素成分。從浮游植物細胞中提取出了AZA1、AZA2和AZA3三種成分。AZA 毒素的理化性質明顯區別於其他含氮生物毒素,在1.0mol/L的乙酸/甲醇溶液或1.0 mol/L的氨水溶液中加熱150 min後其毒性沒有明顯變化,在冷藏條件下可長期儲存。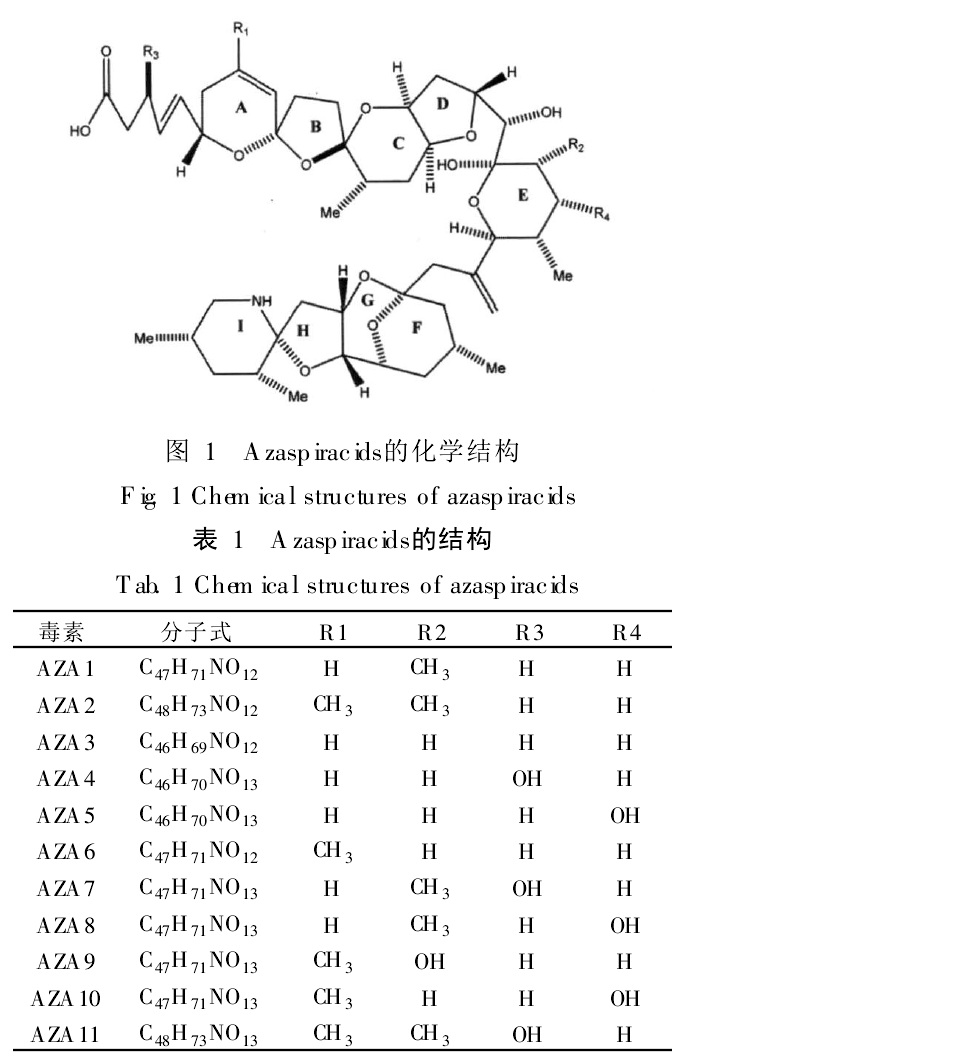 原多甲藻酸貝類毒素分子結構
原多甲藻酸貝類毒素分子結構
 原多甲藻酸貝類毒素分子結構
原多甲藻酸貝類毒素分子結構毒性
AZA最初從愛爾蘭西海岸的紫貽貝中檢出。隨著養殖貝類染毒的區域逐步擴大,染毒貝類的種類也逐漸增多。在英國、挪威、法國和西班牙等國家的養殖貝類中也檢出了AZA。紫貽貝、貽貝(Mytilus gallo provincialis)、長牡蠣[Ostrea(Crassostrea)gigas]和大扇貝(Pectenmaximus)等均檢出含有該類毒素。例如,在英國Craster和挪威松恩峽灣的紫貽貝肝胰腺中,毒素的總含量分別為0.24×10-6和0.82×10-6;在法國布列塔尼半島大扇貝和西班牙加利西亞省Ria de vigo海區貽貝的消化腺中,毒素的總含量分別為0.32×10-6和0.24×10-6。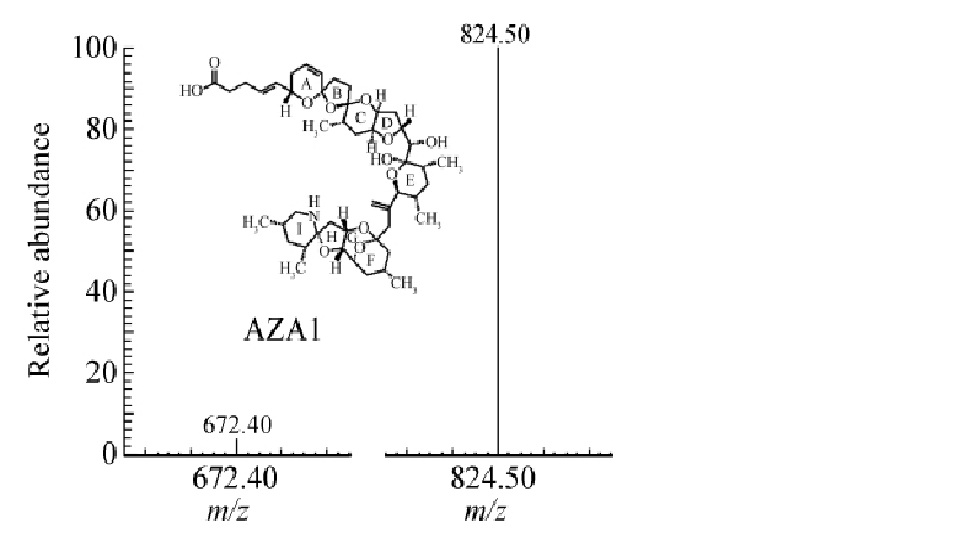 原多甲藻酸貝類毒素電噴霧質譜
原多甲藻酸貝類毒素電噴霧質譜
 原多甲藻酸貝類毒素電噴霧質譜
原多甲藻酸貝類毒素電噴霧質譜AZA毒性比較穩定,常規的烹飪和加工處理無法去除,其毒性遠比大田軟海綿酸(OA)強,尚未找到有效的治療方法和治療藥物。該類毒素有時還與OA、扇貝毒素(PTXs)和蝦夷扇貝毒素(YTXs)同時存在於貝類中,易被腹瀉性貝毒所掩飾,采自挪威的貽貝中曾同時檢出了AZA、OA、PTXs和YTXs。2002年3月,歐洲委員會規定雙殼類、棘皮動物、被囊類和海洋腹足動物(全體或任何可食部分)AZA的最大允許濃度為160×10-9。
此類毒素不同成分的毒性差異很大,AZA2和AZA3均比AZA1毒性強,AZA1、AZA2和AZA3對小白鼠的最小致死劑量分別為0.2×10-6、0.11×10-6和0.14×10-6。與其它聚醚類毒素主要分布於貝類消化腺中不同,AZA遍及貝類全部組織。在染毒初期AZA集中分布於貝類消化腺中,後期則轉移到其它組織(如肌肉)中,毒性可在貝體內持續存留8個月之久,自然淨化速率非常慢。不同成分分布於貝類的不同組織中,AZA1主要分布於消化腺,而AZA3則主要分布於消化腺以外的其它組織。
毒理
AZA 的致毒機理還沒有一個明確的說法。小鼠口服AZA1 毒素的毒性實驗發現,AZA1 可引起肺、胃腸、肝、淋巴組織(胸腺和脾)等多個器官組織受到不同程度的損傷,這些病變在亞致死條件下可在數月內恢復。在慢性毒性實驗中出現間質性肺炎和小腸絨毛萎縮症狀,嚴重者出現肺腫瘤細胞發育。另外發現,AZA1 在低濃度(IC50=2.1 nmol/L)條件下可降低小鼠脊髓神經元的生物電活性,其影響神經元突觸傳遞的機制與門控通道無關。由此看來,向小鼠腹腔注射AZA1 後表現出的急性神經毒性症狀雖與PSP中毒相似,但其作用機制完全不同。
AZA人體的作用機制及其在貝體內的動力學過程正處於探索階段。AZA1 對多種細胞具有毒性,毒性大小與時間、濃度有關。研究發現,AZA1依靠自身特有的ABCDE和FGHI環結構與人神經母細胞瘤作用靶點結合,導致肌動蛋白重排,這一過程不受調控細胞凋亡的天冬氨酸特異性半胱氨酸蛋白酶(Caspases) 家族酶活性的影響;AZA1在改變細胞骨架的過程中不改變膜電壓,與OA相比可明顯提高人淋巴細胞內環磷酸腺苷(cAMP)和胞液Ca2+濃度;另外人T型淋巴細胞對AZA1也非常敏感,壞疽的細胞毒害症狀隨著與AZA1的接觸而逐漸消退。由此看來,AZA的細胞毒害作用機制與OA是不同的,其通過特殊的結構基團與細胞結合,具有特定的細胞作用靶點,使得纖維肌動蛋白發生重排,從而改變細胞骨架而OA毒素主要是通過抑制蛋白磷酸酶的活性。
AZA主要引起人體胃腸道紊亂,與腹瀉性貝毒(DSP)和細菌性腸毒素引起的人體中毒症狀極其相似。通常在進食12~24 h後發作,主要表現為噁心、嘔吐、嚴重腹瀉、胃絞痛、發冷和頭痛,持續時間短則1~2d,最長可達3~5 d。
檢測方法
截止至2008年,對AZP的檢測方法基本上集中於小鼠生物測定法和高效液相色譜法(HPLC),尤其以高效液相色譜與質譜聯用技術(HPLC-MS)的套用最為廣泛。
小鼠生物測定法(mouse bioassay,MBA)的原理是,採用適宜的化學提取方法,將樣品(有毒藻類或染毒貝類)中的毒素轉移到提取液中,通過向固定種系和體重的小白鼠腹腔注射提取液,記錄小白鼠的存活時間以計算樣品的毒素含量。此法是最常用的貝毒分析方法,並被美國分析化學家協會(AOAC)列為PSP的常規檢測方法。小鼠生物測定法具有可靠性強、使用廣泛、能表達出樣品中實際毒性、不需複雜設備等優點;但不夠靈敏、準確性和重現性差、試驗需處理大量動物、不能判定各毒素的成分、操作技巧要求較高、對試驗動物的種系及體重要求苛刻。傳統的小鼠生物測試法只用肝胰腺做測定,只能檢測到貝類組織中AZA總量的0%-40%,因此存在較高比例的假陰性結果。
HPLC方法的原理是,利用毒素分子上的羧基與螢光物質反應,生成強螢光物質,再進行檢測。HPLC法具有靈敏、準確、可靠、特異性和重現性好、能確定各種毒素成分、使用廣泛、易校正、所需檢測的樣品量少等優點;但毒素標準品價格昂貴、樣品前處理要求較高、需昂貴的設備及高素質的操作人員。液相色譜-串聯質譜聯用技術(LC-MSn)不需使用標準毒素,特別適用於確認毒素和鑑別新毒素。LC/MS法對AZA1的檢測限為50×10-12g,靈敏度為小鼠生物測試的80000倍。Micro-LC-MS-MS法對AZA1的檢測限為20×10-12g。四級桿串聯質譜儀(triple-quadrupole massspectrometer)可以檢測到10-15g濃度水平。