冷凍電子斷層掃描是從20世紀70年代提出的,經過近10年的努力,在80年代趨於成熟。它的研究對象非常廣泛,包括病毒、膜蛋白、肌絲、蛋白質核苷酸複合體、亞細胞器等等。
一方面,冷凍電子斷層掃描技術所研究的生物樣品既可以是具有二維晶體結構的,也可以是非晶體的;而且對於樣品的分子量沒有限制。因此,大大突破了X-射線晶體學只能研究三維晶體樣品和核磁共振波譜學只能研究小分子量(小於100KDa)樣品的限制。另一方面,生物樣品是通過快速冷凍的方法進行固定的,克服了因化學固定、染色、金屬鍍膜等過程對樣品構象的影響,更加接近樣品的生活狀態。
基本介紹
- 中文名:冷凍電子斷層掃描
- 外文名:cryo-electron tomography(cryo-ET)
- 專業:結構生物學技術
背景,技術流程,樣品製備,數據收集,系列投影圖像的配準,斷層圖像的三維重構,重建結果的去噪、分割和理解,特點,冷凍電子斷層成像技術展望,
背景
冷凍電鏡方法結合三維重構技術近年來在結構生物學領域發展迅速並正在取得重要突破。與X- 射線晶體學和核磁共振波譜學(NMR) 等傳統的測定蛋白質分子三維結構的方法相比較, 它具有以下幾個方面的優勢: 1) 保持生物樣品的活性和功能狀態; 2) 無須製備晶體, 特別適合難於結晶的大分子及其複合物的三維結構判定; 3) 結合新型的電子顯微鏡、制樣機器人等設備和技術, 可以實現顯微制樣、數據收集、三維重構全過程的自動化或半自動化, 為高通量、快速解析大分子及其複合物的三維結構打下基礎。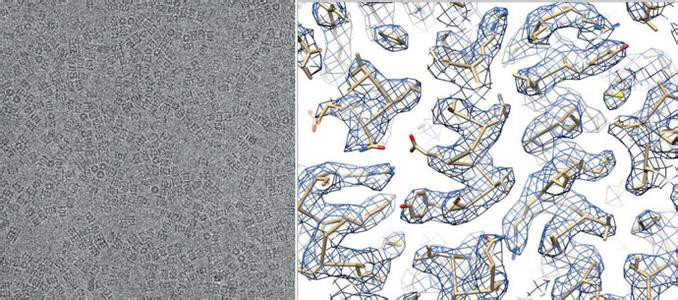 冷凍電鏡助力結構生物學
冷凍電鏡助力結構生物學
 冷凍電鏡助力結構生物學
冷凍電鏡助力結構生物學電子斷層成像通過獲取同一區域多個角度的投影圖來反向重構所研究對象的三維結構,適合於在納米級尺度上研究不具有結構均一性的蛋白、病毒、細胞器以及它們之間組成的複合體的三維結構。與蛋白質電子晶體學和單顆粒技術相比, 這種技術無需樣品顆粒具有結構同一性, 也不強調樣品具有一定的對稱性。因此, 雖然目前電子斷層成像所獲得的結構的解析度(約4~10 納米) 不能與以上兩種技術相比, 但其在研究非定形、不對稱和不具全同性的生物樣品的三維結構和功能中有著不可替代的重要作用。
冷凍電子斷層成像的適用尺度非常廣泛, 包括從分子水平的蛋白質, 到亞細胞水平的細胞器, 以至細胞水平的組織結構。它有效地填補了X- 射線晶體學、核磁共振以及冷凍電鏡單顆粒分析等方法得到的高精度結構和光學顯微鏡技術得到的低解析度的細胞整體圖像之間的空白。同時, 利用冷凍電子斷層成像法在獲得體外或細胞環境下大複合體或分子機器的納米精度的三維結構後, 嵌入組成這些大複合體或分子機器的各亞單元的通過X- 射線晶體學、NMR 或單顆粒分析等方法得到的原子解析度結構, 可以得到生理環境下重要分子機器在細胞環境中的三維空間分布以及組裝, 從而為深入理解這些分子機器的相互作用機理提供重要而有益的信息。因此, 電子斷層成像技術近年來在冷凍電鏡研究領域得到越來越多的關注, 也被2002 年《科學》雜誌評為當年的十大科技突破之一。
技術流程
樣品製備
快速冷凍制樣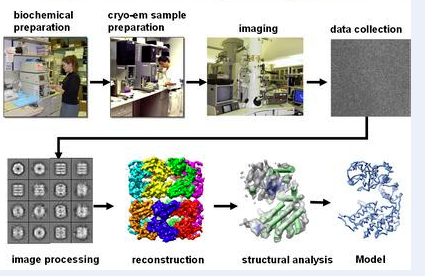

對於一些電子束能穿透的較小或較薄的樣品, 如病毒、細菌, 以及一些小細胞等, 可以採用與單顆粒分析制樣方法相同的快速冷凍(plunge-freezing) 的方法準備樣品並進行冷凍電子斷層成像研究。冷凍電子斷層成像的主要優勢是樣品接近於天然狀態, 克服了由於化學固定、脫水、冷凍替代和染色等帶來的可能的假象, 很好地保護了生物樣品結構的完整性。
高壓冷凍、冷凍替代以及冷凍切片
由於水是熱的不良導體, 對於大的樣品(如整個細胞), 冷凍能達到的深度和體積是非常有限的。雖然常規的通過化學固定、樹脂包埋、切片、染色等步驟進行制樣的方法對細胞和組織器官等的電子斷層成像也取得了許多很好的成果, 但是制樣過程仍然會引起一些結構畸變, 影響了樣品的結構細節。對厚樣品可以採用高壓冷凍(high pressure freezing,利用高壓降低水的冰點使得冷凍達到更深的層次), 隨後進行冷凍替代(freeze substitute,在低溫下用有機溶劑將冷凍組織進行置換脫水), 逐漸升溫後進行傳統的包埋、切片等步驟進行制樣。利用這種方法製備的樣品在結構細節的保持上可以取得較好的效果。而真正能使大細胞和組織保持天然狀態的制樣辦法是高壓冷凍並進行冷凍切片(cryo-sectioning)。
數據收集
電子斷層成像的數據收集從找到合適的成像區域開始。在起始位置成像後, 樣品傾轉到下一個角度, 對同一區域進行成像。電子斷層成像的數據收集的大概過程如下: 1) 尋找( search) 合適區域, 一般在較低放大倍數下進行; 2) 調節樣品台傾轉中心高度(eucentricity), 使樣品台傾轉時樣品維持在成像中心範圍; 3) 調焦(focus); 4) 找到同一成像區域的精確跟蹤(tracking); 5) 照相(exposure); 6) 樣品傾斜到一個更高角度後,重新找到樣品的位置中心, 然後重複以上四個模式, 即search、focus、tracking、exposure幾個模式交替進行。
系列投影圖像的配準
電子斷層成像三維重構要經過兩個步驟, 首先是不同角度的投影圖像的配準, 其次是配準後圖像的反向投影進行tomogram 的三維重建。對一個傾斜系列投影的圖像進行配準是獲得高質量重構的重要基礎。圖像配準主要是計算傾轉過程中由於樣品台等的移動使得圖像中心的移動; 其次, 還需對由於不完美的成像條件導致的傾轉角度, 圖像自身的旋轉、扭曲以及放大倍數等進行修正。這種修正將顯著提高三維重建的質量。
圖像配準有兩種最常用的方法: 即基於標記點的方法與基於圖像互相關匹配的方法。
斷層圖像的三維重構
電子斷層圖像的三維重構是由所有配準的傾轉投影圖重新反向投影到一個3D 體積中形成的。最常用的方法是加權背投影(weighted back projection, WBP), 將每個二維投影圖像背向其記錄時的傾斜角方向投影到三維空間中, 所有背投影圖像在三維空間中疊加形成樣品的三維結構。
重建結果的去噪、分割和理解
重建結果要進行適當的降噪處理以突出研究對象。常用的去噪處理方式包括中值濾波、非線性濾波等。
特點
cryo-ET的開發和套用使我們可以在天然狀態下、原子解析度水平上觀察細胞內部的精密結構成為了可能,從而為進一步深入認識生命奧秘帶來了新的希望。
優點:在細胞內環境研究蛋白質複合體和細胞器(接近自然,不用固定、脫水、染色);平均解析度在4~5nm,可達到~2~3nm,蛋白質和細胞相互作用可視化;洞察蛋白質相互作用的網路,捕捉動態過程。
限制: 尚未具有原子級的解析能力;低對比度和樣品的輻射損傷。
冷凍電子斷層成像技術展望
冷凍電子顯微學和電子斷層成像依然是一個年輕的學科, 處於發展和完善階段, 無論在理論上還是實踐上都有許多工作要做。隨著設備的改進和套用的範圍的擴大, 冷凍電子斷層成像的全自動、高通量數據收集以及高效三維重構也有更為迫切的需求。因此, 探討和發展新的樣品製備、數據採集、圖像處理和三維重構方法, 將X-ray/NMR 數據與電子斷層數據整合、擴展數據範圍、提高結構解析的解析度, 是電子斷層成像領域要解決的技術問題。

