基本介紹
- 中文名:辣根過氧化物酶
- 外文名:Horseradish Peroxidase,HRP
- 酶學分類號:EC 1.11.1.7
- 來源:辣根
簡介
該酶催化
用途
製備
實驗原理
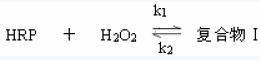 第一步
第一步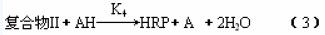 第三步
第三步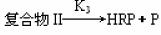
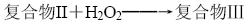
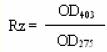
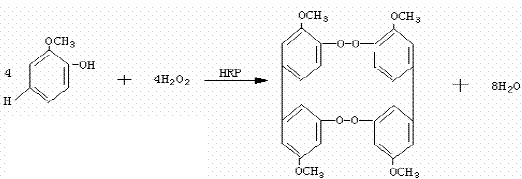
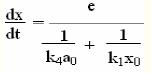
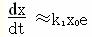

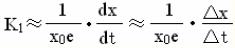
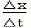
儀器和試劑
操作步驟
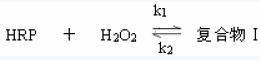 第一步
第一步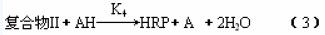 第三步
第三步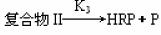
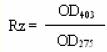

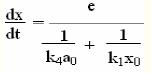
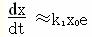

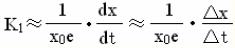
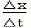

過氧化物酶,通常來源於辣根(因此稱辣根過氧化物酶),是臨床檢驗試劑中的常用酶。該產品不但廣泛用於多個生化檢測項目,也廣泛運用於免疫類(ELISA)試劑盒。過氧化物...
通常來源於辣根(因此稱),是臨床檢驗試劑中的常用酶。該產品不但廣泛用於多個生化檢測項目,也廣泛運用於免疫類(ELISA)試劑盒。過氧化物酶作為多個試劑盒顯色體系...
過氧化物酶是由微生物或植物所產生的一類氧化還原酶,它們能催化很多反應。過氧化物酶是以過氧化氫為電子受體催化底物氧化的酶。主要存在於載體的過氧化物酶體中,...
辣根過氧化物酶標記免疫球蛋白結合物編輯 鎖定 基本信息規格: 1ml劑型 : 診斷試劑批准日期 : 2002-12-18批准文號 : 國藥準字S10870018藥品類型 : 生物製品V...
辣根過氧化物酶(HRP)是一種糖蛋白,每個分子含有一個氯化血紅素(protonhemin)區作輔基。 ...
辣根過氧化物酶標記免疫球蛋白結合物-羊抗兔IgG結合物,批准文號 為國藥準字S10870049。...
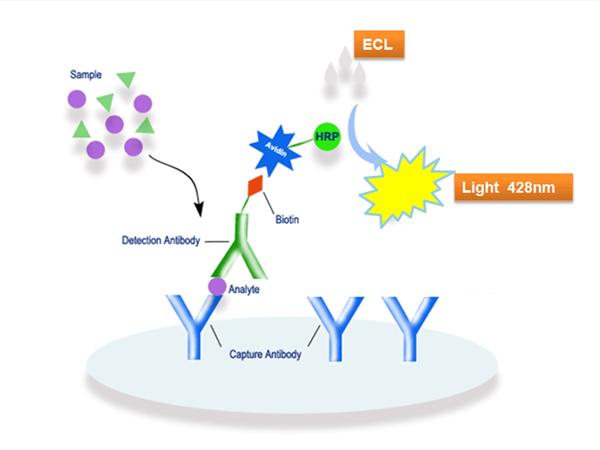
過氧化酶是化學藥品...... 過氧化酶用途說明 編輯 辣根過氧化物酶是目前使用最廣泛的一種標記酶,用來標記抗體或其它蛋白質,既能用於定位檢測,也能用於定量測定。...
酶標記抗體的質量主要取決於純度好、活性強及親和力高的酶和抗體,其次要有良好的製備方法。目前,高質量的酶(如辣根過氧化物酶,簡稱HRP)國內已有商品供應。高質量...
酶生物感測器的基本結構單元是由物質識別元件(固定化酶膜)和信號轉換器(基體電極...到目前為止,只發現辣根過氧化物酶、葡萄糖氧化酶、醋氨酸酶、細胞色素C過氧化...
辣根過氧化物酶標記免疫球蛋白結合物-羊抗鼠IgG結合物編輯 鎖定 基本信息規格: 0.5ml劑型 : 體外診斷試劑批准日期 : 2003-5-31批准文號 : 國藥準字S10870048...
辣根過氧化物酶標記免疫球蛋白結合物-羊抗人IgG結合物編輯 鎖定 基本信息規格: 0.5ml劑型 : 體外診斷試劑批准日期 : 2003-5-31批准文號 : 國藥準字S10870046...
辣根過氧化物酶標記免疫球蛋白結合物-兔抗鼠IgG結合物編輯 鎖定 基本信息規格: 0.5ml劑型 : 體外診斷試劑批准日期 : 2002-12-18批准文號 : 國藥準字S10870045...
過氧化物酶廣泛分布於植物中,辣根中含量最高,從辣根中提取的稱辣根過氧化物酶(HRP),是由無色酶蛋白和深棕色的鐵卟啉構成的一種糖蛋白(含糖量18%),分子量約...
辣根過氧化物酶標記免疫球蛋白結合物-羊抗人IgM結合物編輯 鎖定 基本信息規格 : 0.5ml劑型 : 體外診斷試劑批准日期 : 2003-5-31批准文號 : 國藥準字S...
根據所用的標記物不同,可分為:辣根過氧化物酶免疫斑點試驗(使用辣根過氧化物酶作為抗抗體的標記物),鹼性磷酸酶免疫斑點試驗(使用鹼性磷酸酶抗鹼性磷酸酶複合物...
6、加入辣根過氧化物酶偶聯的二抗(按合適稀釋比例用0.01M PBS稀釋),平穩搖動,室溫2hr。7、棄二抗,用0.01M PBS洗膜,5min×4次。8、加入顯色液,避光顯色至...
根據抗原抗體反應和化學顯色原理,組織切片或細胞標本中的抗原先和一抗結合,再利用一抗與標記生物素、螢光素等的二抗進行反應,前者再用標記辣根過氧化物酶(HRP)或...
—— 70年代 Stemberger 改良上述技術,建立辣根過氧化物酶——抗體過氧化物酶(PAP)技術,使免疫細 胞化學得到廣泛套用。—— 80年代 Hsu 等建立了抗生物素—生...
濃度。ELISA中用的比較多的是辣根過氧化物酶(HRP),底物為OPD, 深桔黃色 ,檢測波長492nm;TMB, 藍綠色,檢測波長450nm 鹼性磷酸酶,底物為PNPP(對-消基苯磷酸酯...
該抗體往往是購買的成品,已經被結合或標記了特定的試劑,如辣根過氧化物酶。這種標記是利用辣根過氧化物酶所催化的一個比色反應,該反應的產物有特定的顏色且固定在...
