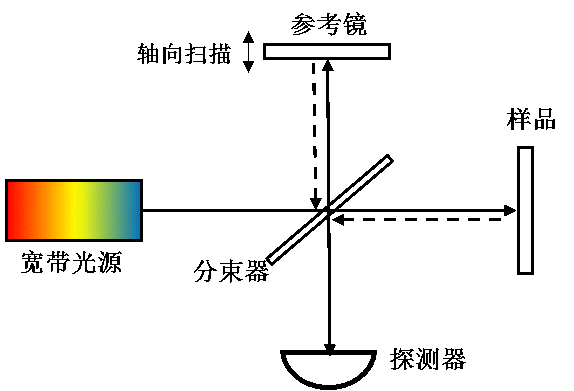理論
1.時域光學相干層析成像術(time domain optical coherence tomography,TDOCT)
由於縱向採用時間/空間逐點掃描的機制,成像速度受限,一般認為TDOCT屬於OCT的第一代技術。如圖2所示,TDOCT一般以麥可遜干涉儀為主體,利用單點探測器記錄寬頻光源(如超發光二極體)低相干干涉的時域信號。若且唯若參考臂與樣品臂的光程完全匹配的情況下,才能產生干涉信號。通過參考臂的掃描,實現樣品內部縱向信息(深度方向)的逐點獲取。由於該掃描機制的限制,TDOCT的軸向線掃描速度(A-line)一般被限制在2-4kHz,極大的限制了TDOCT的成像速度。但是,由於其靈敏度不隨深度增加而衰減,目前,TDOCT仍然用於眼前節、冠狀動脈等需要較大量程的情況。
圖2. 時域光學相干層析成像(TDOCT)系統示意圖
2.傅立葉域光學相干層析成像術(Fourier domain optical coherence tomography,FDOCT)
由於縱向改用傅立葉域並行探測的機制,成像速度獲得了極大的提升,FDOCT一般認為是OCT的第二代技術。FDOCT通過記錄低相干干涉的光譜信號,利用傅立葉分析,實現縱向的空間結構信息的並行獲取。目前,根據干涉光譜信號的獲取方式的不同,FDOCT大致有兩種實現方法:光譜域OCT和掃頻OCT。
2.1 光譜域光學相干層析成像術(Spectral domain optical coherence tomography,SDOCT)
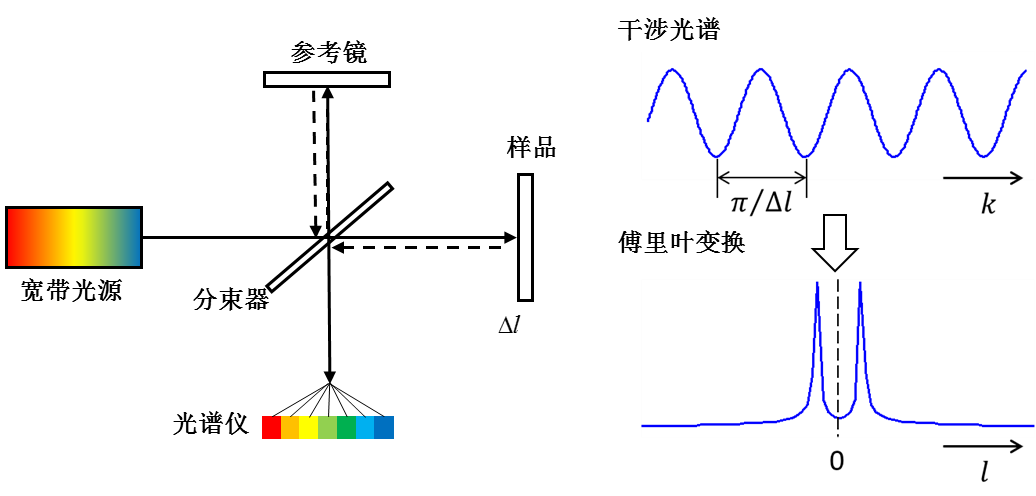
如圖3所示,SDOCT一般以麥可遜干涉儀為主體,利用線陣相機同時記錄寬頻光源(如超發光二極體)的低相干干涉光譜信號,通過傅立葉變換,實現樣品內部縱向信息(深度方向)的並行獲取。該技術不需要參考臂的機械掃描,A-line速度主要決定於相機的曝光頻率,一般可以達到幾十kHz,甚至數百kHz,是目前臨床眼科套用的主流技術。
圖3 光譜域光學相干層析成像(SDOCT)系統示意圖
2.2 掃頻光學相干層析成像技術(Swept source optical coherence tomography,SSOCT)
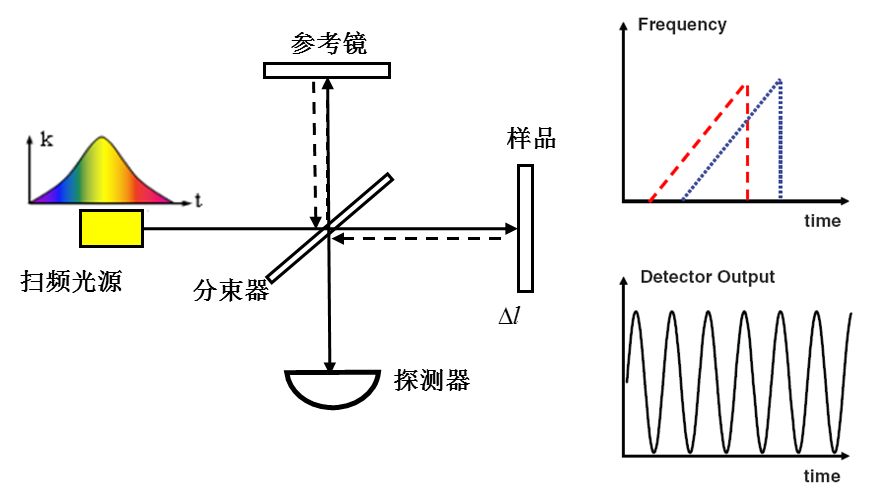
如圖4所示,SSOCT一般以麥可遜干涉儀為主體,利用點探測器分時記錄寬頻掃頻光源的低相干干涉光譜信號,通過傅立葉變換,實現樣品內部縱向信息(深度方向)的並行獲取。該技術的成像速度主要決定於光源的掃頻頻率。得益於高速掃頻光源技術的發展,該OCT技術目前最高可以實現數MHz的縱向線掃描速度,具有良好的發展前景。
圖4 掃頻光學相干層析成像(SSOCT)系統示意圖
功能拓展套用
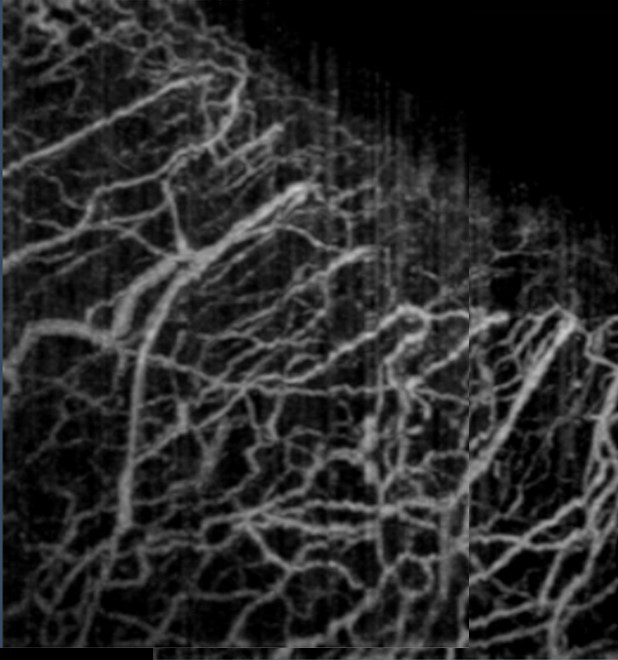
普通OCT技術可以實現組織內部微觀形態結構的三維活體成像,通過與Doppler技術、光譜技術、偏振技術等結合,可以獲得三維空間分辨的生物組織生理功能信息。特別是,通過將OCT與動態散射技術結合可以實現無標記三維微血管造影,獲得組織內部血流灌注的三維活體成像。
圖5. 人眼角鞏膜緣處微血管造影[2]
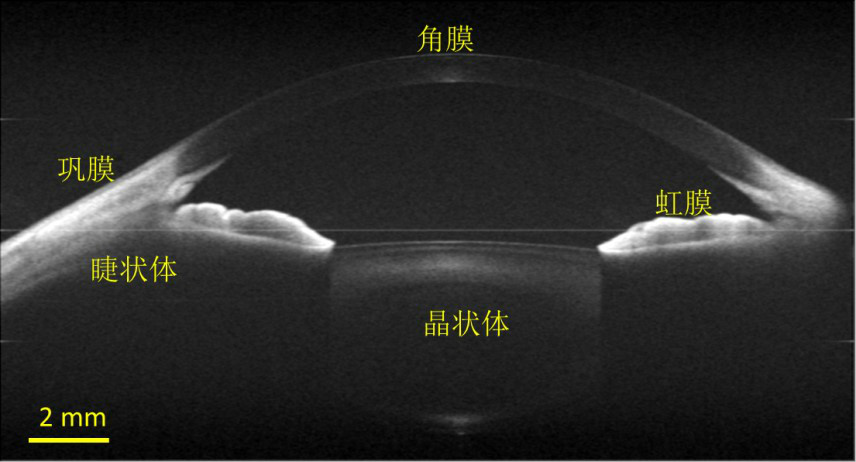
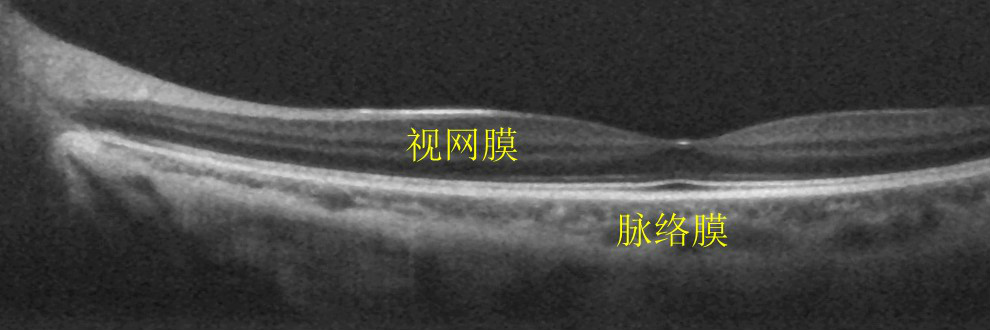
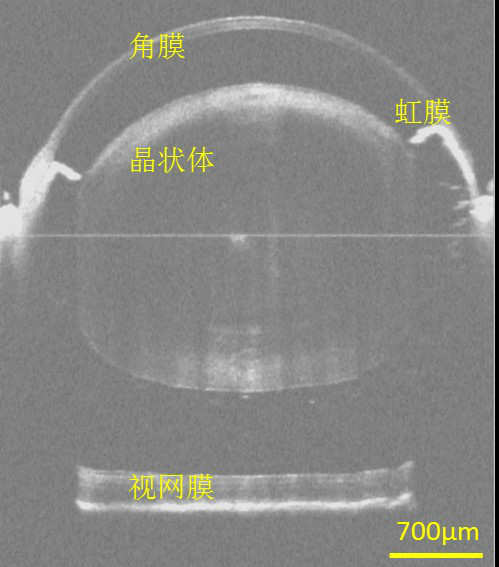
在臨床眼科中,OCT可以實現眼前節(角膜、房角、晶狀體等)、視網膜和脈絡膜等重要眼組織的活體三維成像,可用於糖尿病性視網膜病變、老年性黃斑變性和青光眼等疾病的診斷和治療。OCT還可以用於冠狀動脈、消化道、呼吸道、腦皮層、癌症、皮膚等生物組織的成像,以及某些材料特性的檢測。
圖6. 人眼活體全眼前節大視場OCT斷層成像[3]
圖7. 人眼活體眼底大視場OCT斷層成像[4]
擴展閱讀
1. P. Li, Z. Ding, Y. Ni, B. Xu, C. Zhao, Y. Shen, C. Du, and B. Jiang, "Visualization of the ocular pulse in the anterior chamber of the mouse eye in vivo using phase-sensitive optical coherence tomography," Journal of Biomedical Optics 19, 090502-090502 (2014).
2. P. Li, L. An, R. Reif, T. T. Shen, M. Johnstone, and R. K. Wang, "In vivo microstructural and microvascular imaging of the human corneo-scleral limbus using optical coherence tomography," Biomed. Opt. Express 2, 3109-3118 (2011).
3. P. Li, L. An, G. Lan, M. Johnstone, D. Malchow, and R. K. Wang, "Extended imaging depth to 12mm for 1050-nm spectral domain optical coherence tomography for imaging the whole anterior segment of the human eye at 120-kHz A-scan rate," Journal of Biomedical Optics 18, 016012-016012 (2013).
4. L. An, P. Li, G. Lan, D. Malchow, and R. K. Wang, "High-resolution 1050 nm spectral domain retinal optical coherence tomography at 120kHz A-scan rate with 6.1 mm imaging depth," Biomed. Opt. Express 4, 245-259 (2013).
5. D. Huang, E. Swanson, C. Lin, et al., Optical coherence tomography. Science, 1991, 254: 1178-1181.
6. M. Choma, M. Sarunic, C. Yang, et al., Sensitivity advantage of swept source and Fourier domain optical coherence tomography. Opt. Express, 2003, 11(18): 2183-2189.
7. J. G. Fujimoto, M. E. Brezinski, G. J. Tearney, et al., Optical biopsy and imaging using optical coherence tomography. Nat. Med., 1995, 1: 970-972.
8. J. S. Schuman, C. A. Puliafito, J. G. Fujimoto, Optical Coherence Tomography of Ocular Diseases, 2nd edn. Slack Inc., Thorofare, NJ, 2004.
9. S. Kray, F. Spoler, M. Forst, et al., Dual femtosecond laser multiheterodyne optical coherence tomography. Opt. Lett., 2008, 33: 2092-2094.
10. R. Leitgeb, W. Drexler, A. Unterhuber, et al., Ultrahigh resolution Fourier domain optical coherence tomography. Opt. Express, 2004, 12(10): 2156-2165.
11. Y. Chen, A. D. Aguirre, P. L. Hsiung, et al., optical coherence tomography of Barrett's esophagus: preliminary descriptive clinical study correlating images with histology. Endoscopy, 2007, 39: 599-605.
12. T. Ko, D. Adler, J. Fujimoto, et al., Ultrahigh resolution optical coherence tomography imaging with a broadband superluminescent diode light source. Opt. Express, 2004, 12(10): 2112-2119.
13. B. Bouma, G. J. Tearney, S. A. Boppart, et al., High-resolution optical coherence tomographic imaging using a mode-locked Ti:Al2O3 laser source. Opt. Lett., 1995, 20(13): 1486-1488.
14. W. Drexler, U. Morgner, R. K. Ghanta, et al., Ultrahigh-resolution ophthalmic optical coherence tomography.Nat. Med., 2001, 7: 502-507.
15. T. H. Ko, J. G. Fujimoto, J. S. Duker, et al., Comparison of ultrahigh- and standard-resolution optical coherence tomography for imaging macular hole pathology and repair. Ophthalmology, 2004, 111: 2033-2043.
16. A. F. Fercher, C. K. Hitzenberger, G. Kamp, et al., Measurement of intraocular distances by backscattering spectral interferometry. Opt. Commun., 1995, 117: 43-48.
17. R. Leitgeb, C. Hitzenberger, and A. Fercher, Performance of fourier domain vs. time domain optical coherence tomography. Opt. Express, 2003, 11(8): 889-894.
18. J. F. de Boer, B. Cense, B. H. Park, et al., Improved signal-to-noise ratio in spectral-domain compared with time-domain optical coherence tomography. Opt. Lett., 2003, 28(21): 2067-2069.
19. M. Wojtkowski, R. Leitgeb, A. Kowalczyk, et al., In vivo human retinal imaging by Fourier domain optical coherence tomography. J. Biomed. Opt., 2002, 7: 7457-7463.
20. N. Nassif, B. Cense, B. Park, et al., In vivo high-resolution video-rate spectral-domain optical coherence tomography of the human retina and optic nerve. Opt. Express, 2004, 12: 367-376.
21. S. R. Chinn, E. A. Swanson, and J. G. Fujimoto, Optical coherence tomography using a frequency-tunable optical source. Opt. Lett., 1997, 22(5): 340-342.
22. S. Yun, G. Tearney, J. de Boer, et al., High-speed optical frequency-domain imaging. Opt. Express, 2003, 11(22): 2953-2963.
23. S. H. Yun, G. J. Tearney, B. J. Vakoc, et al., Comprehensive volumetric optical microscopy. Nat. Med., 2006, 12: 1429-1433.
24. D. C. Adler, Y. Chen, R. Huber, et al., Three-dimensional endomicroscopy using optical coherence tomography. Nat. Photonics, 2007, 1: 709-716.
25. Y. Zhao, Z. Chen, C. Saxer, et al., Phase-resolved optical coherence tomography and optical Doppler tomography for imaging blood flow in human skin with fast scanning speed and high velocity sensitivity. Opt. Lett., 2000, 25: 114-116.
26. R. K. Wang, S. L. Jacques, Z. Ma, et al., Three dimensional optical angiography. Opt. Express, 2007, 15: 4083-4097.
27. Z. Chen, Y. Zhao, and S. Srinivas, Doppler Optical Coherence Tomography. IEEE J. Sel. Topics Quant. Electron., 1999, 5: 1134-1142.
28. C. L. Evans, E. O. Potma, and X. S. Xie, Coherent anti-Stokes Raman scattering spectral interferometry: determination of the real and imaginary components of nonlinear susceptibility X for vibrational microscopy. Opt. Lett., 2004, 29(24): 2923-2925.
29. Wang C, Ding Z, Mei S, et al. Ultralong-range phase imaging with orthogonal dispersive spectral-domain optical coherence tomography[J]. Opt. Lett., 2012, 37(21): 4555-4557.
30. Bao W, Ding Z, Li P, et al. Orthogonal dispersive spectral-domain optical coherence tomography[J]. Opt. Express, 2014, 22(8): 10081-10090.
徐可欣, 高峰, 趙會娟. 生物醫學光子學. 科學出版社. 2011年7月, 第2版.
張鎮西. 生物醫學光子學新技術及套用. 科學出版社. 2008年5月, 第1版
王凱. 譜域光學相干層析成像方法與系統研究[D].浙江大學, 2010.
孟婕. 都卜勒光學相干層析成像方法與套用研究[D].浙江大學, 2010.