基本介紹
- 中文名:二元相圖
- 外文名:binary diagram
- 又稱:二元系相圖
- 屬性:相圖
簡介,相平衡條件,槓桿規則,槓桿規則推導,槓桿規則含義,二元系統相圖的基本類型,
簡介
二元相圖又稱二元系相圖,是表示系統中兩個組元在熱力學平衡狀態下組份和溫度、壓力之間的關係的簡明圖解。最初,相圖通過大量實驗得到。隨著計算材料學的發展,以分子動力學為基礎的計算相圖成為得到相圖的一種高效手段。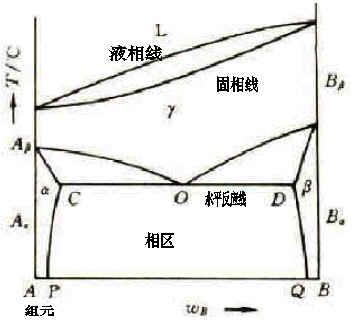 二元相圖
二元相圖
 二元相圖
二元相圖相平衡條件
幾何規律
1)兩個單相區之間必定有一個由這兩個相組成的兩相區,而不能以一條線接界。這個規律被稱為相區接觸法則。
2)在二元相圖中,若是三相平衡,則三相區必為一水平線。
3)如果兩個恆溫轉變中有兩個相同的相,則這兩條水平線之間一定是由這兩個相組成的兩相區。
4) 當兩相區與單相區的分界線與三相等溫線相交,則分界線的延長線應進入另一兩相區,而不會進入單相區。
槓桿規則
槓桿規則推導
槓桿規則是相圖分析中一個重要的規則,它可以計算在一定條件下,系統中平衡各相間的數量關係。假設由A和B組成的原始混合物(或熔體)的組成為M,在某一溫度下,此混合物分成兩個新相,兩相的組成分別為M1和M2,見圖。
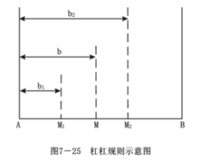
若組成為M的原始混合物含B為b%,總質量為G;新相M1含B為b1%,質量為G1;新相M2含B為b2%,質量為G2。因變化前後、後的總量不變,所以:G=G1+G2(1)。
原始混合物中B的質量為G(b%),新相M1中B的質量為G1·b1%,新相M2中B的質量為C2·b2%。所以:Gb%=G1b1%+G2b2%將(1)式代入,得:
(G1+G2)b%=G1b1%+G2b2% ;G1(b-b1)=G2(b2-b) (2)
所以:G1·M1M=G2·MM2 (3)
兩個新相M1和M2在系統中的含量則為:
G1=(MM2/M1M2)% (4)
G2=(M1M/M1M2)% (5)
上式表明:如果一個相分解為二個相,則生成的兩個相的數量與原始相的組成點到兩個新生相的組成點之間線段成反比。此關係式與力學上的槓桿很相似,如圖所示:
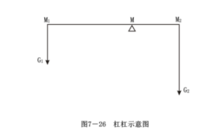
M點相當於槓桿的支點,M1和M2則相當於兩個力點,因此稱為槓桿規則。
槓桿規則含義
可以看出,系統中平衡共存的兩相的含量與兩相狀態點到系統總狀態點的距離成反比。即含量愈多的相,其狀態點到系統總狀態點的距離愈近。使用槓桿規則的關鍵是要分清系統的總狀態點,成平衡的兩相的狀態點,找準在某一溫度下,他們各自在相圖中的位置。
二元系統相圖的基本類型
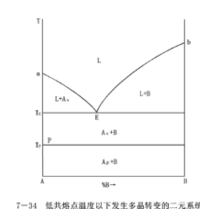
1、具一個低共熔點的二元系統相圖
這類系統的特點是:兩個組元在液態時能以任意比例互溶,形成單相溶液;固相完全不互溶,兩個組元各自從液相分別結晶;組元間不生成化合物。這種相圖是最簡單的二元系統相圖。
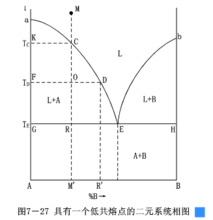
相圖分析:
表示出一個最簡單的二元系統相圖。圖中的a點是純組元A的熔點,b點是純組元B的熔點。aE線是組成不同的高溫熔體在冷卻過程中開始析出A晶相的溫度的連線,在這條線上液相和A晶相兩相平衡共存。bE線是不同組成的高溫熔體冷熔體冷卻過程中開始析出B晶相的溫度的連線,線上液相和B晶相兩相平衡共存。aE線、bE線都稱為液相線,分別表示不同溫度下的固相A、B和相應的液相之間的平衡,實際上也可以理解為由於第二組元加入而使熔點(或凝固點)變化的曲線。
根據相律,在液相線上P=2,F=1。通過E點的水平線GH稱為固相線,是不同組成熔體結晶結束溫度的連線。液相線和固相線之間的兩個相區aEG和bEH分別為A晶相和液兩條液相線和固相線把整個相圖分為四個相區:液相線以上的區域是液相的單相區,用L表示,在單相區內P=1,F=2。相平衡共存(L+A)以及B晶相和液相平衡共存(L+B)的二相區,在該兩區域內的液相組成可用結線(等溫線)與對應曲線的交點決定。
FD線表示溫度在TD時的A晶相與該溫度下組成為D的液相平衡。固相線以下的區域是A晶相和B晶相平衡共存(A+B)的相區,在兩相平衡共存的相區內P=2,F=1。兩條液相線與固相線的交點E稱為低共熔點。在這點上組成為E’的液相與A晶相、B晶相三相平衡並存,其平衡關係式為LE↔A+B。就是說,冷卻時相在E點,按E’點的A、B比例同時析出A金相和B金相;加熱時按E’點的A、B比例。這是系統加熱時熔融成液相的最低溫度,稱為低共熔點,在該點析出的固體混合物稱為低共熔混合物。在E點相數P=3自由度數F=0,表示系統的溫度和液相的組成都不能變,故E點是二元無變數點。在此點,當系統被加熱或冷卻時,只是引起液相對固相的比例量的增加或減少,溫度和組成沒有變化。
2、具有一個化合物的二元系統相圖
(1)具有一個一致熔融化合物的二元系統相圖
一致熔融化合物是一種穩定的化合物,與正常的純物質一樣具有固定的熔點,加熱這樣的化合物到熔點時,即熔化為液態,所產生的液相與化合物的晶相組成相同,故稱為一致熔融或同成分熔融,其化合物則稱為一致熔融化合物或同成分熔融化合物。由於這種化合物有確定的同成分熔點,並且此熔點在加入其它任一純組元時會降低直到和兩邊純組元的液相線相交得到兩個低共熔點E1、E2為止。這類系統的典型相圖如圖所示。
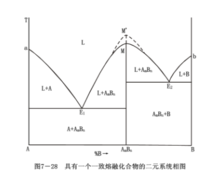
組元A和組元B生成一個一致熔融化合物AmBn,M點是該化合物的熔點。曲線aE1是組元A的液相線,bE2是組元B的液相線,E1ME2則是化合物AmBn的液相線。一致熔融化合物在相圖上的特點是化合物組成點位於其液相線的組成範圍內,即化合物AmBn的等組成線AmBn-M與液相線相交,交點M(化合物的熔點)是液相線上的溫度最高點。因此,AmBn—M線將此相區分成兩個最簡單的分二元系統。E1是A—AmBn分二元系統的低共熔點,在這點上進行的過程是LE1↔A+AmBn,凡是組成在A—AmBn範圍內的原始熔體都在E1點結晶結束,結晶產物為A和AmBn兩種晶相。E2點是AmBn—B分二元系統的低共熔點,在這點上進行的過程是LE2↔B+AmBn,凡組成在AmBn—B範圍內的熔體都在E2點結晶結束,結晶產物是AmBn和B兩種晶相。
其結晶路程(固、液相的變化途徑)與最簡單的二元系統完全相同。整個相圖可看成由兩個最簡單的低共熔類型相圖所組成。因此,當系統中存在n個一致熔融化合物而使相圖複雜化時,只要以一致熔融化合物的等組成線為分界線,便能將該複雜相圖劃分成n+1個簡單系統,則問題的討論就顯得簡單而容易了。一致熔融化合物若是一個非常穩定的化合物,甚至在熔融時也不離解,那么相應的液相線就會出現尖峭高峰形(見圖的M’點),若化合物部分分解時,熔化溫度將降低,則化合物愈不穩定,最高點也愈平滑(見圖的M點)矽灰石(CaO▪SiO2)和鎂橄欖石(Mg2SiO2)便是一致熔融化合物。
(2)具有一個不一致熔融化合物的二元系統相圖
不一致熔融化合物是一種不穩定的化合物,加熱這種化合物到某一溫度便發生分解,分解產物是一種液相和一種晶相,二者與原來化合物組成完全不同,故稱不一致熔融或異成分熔融,其化合物稱為不一致熔融化合物或異成分熔融化合物,它只能在固態中存在,不能在液態中存在。這類系統的典型相圖如圖所示。
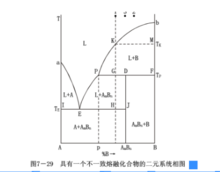
組元A和組元B生成的化合物AmBn加熱到TP溫度分解為P點組成的液相和B晶相,因此AmBn是一個不一致熔融化合物。圖中aE是與晶相A平衡的液相線,bP是與晶相B平衡的液相線,PE是與化合物AmBn平衡的液相線。無變數點E是低共熔點,在E點發生的相變化為LE↔A+AmBn。
另一無變數點P稱為轉熔點,在P點發生的相變化Lp+B↔AmBn,就是說,冷卻時組成為P的液相要回吸B晶相(B溶解於液相),結晶出AmBn晶相;加熱時化合物AmBn分解為液相P和B晶相,這一過程稱為轉熔過程,故P點稱為轉熔點。由於在P點是三相平衡共存,P=3,F=0,所以溫度不能變,液相的組成也不能改變。需要注意,轉熔點P位於與P點液相平衡的兩個晶相AmBn和B的組成點D、F的一側,這與低共熔點E位於與E點液相平衡的兩個晶相A和AmBn的組成點I、J的中間是不同的。運用槓桿規則不難理解這種差別。不一致熔融化合物在相圖上的特點是化合物AmBn的組成點位於其液相線PE的組成範圍以外。
(3)固相中有化合物生成與分解的二元系統相圖
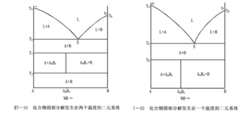
所示為固相中有化合物生成與分解的二元系統相圖,化合物AmBn不能直接從二元溶液中結晶析出。從液相中只能析出A晶相和B晶相。A、B通過固相反應形成化合物AmBn。這類化合物只能存在於某一溫度範圍內(T1~T2),超出這個範圍,化合物AmBn便分解為晶相A和晶相B。不同組成的二元系統在T1(T2)溫度下發生固相反應時可能有三種不同的結果:
a)組成在A~AmBn範圍內的二元系統,由於A組元的含量比較高,冷卻到T1(或加熱到T2)時,固相反應的結果是B晶相消失,剩餘A晶相和新生成的化合物AmBn。
b)組成在AmBn~B範圍內的二元系統,冷卻到T1(加熱到T2)時,固相反應的結果是A晶相消失,剩餘B晶相和新生成的化合物AmBn。
c)組成剛好為AmBn的二元系統,冷卻到T1(或加熱T2)時,固相反應的結果是A、B全部化合生成化合物AmBn。實際上,由於固態物質之間的反應速度很慢,因而達到平衡狀態需要的時間將是很長的。尤其是在低溫下,上述平衡狀態是很難達到的,系統往往處於A、AmBn、B三種晶體。實際上,由於固態物質之間的反應速度很慢,因而達到平衡狀態需要的時間將是很長的。尤其是在低溫下,上述平衡狀態是很難達到的,系統往往處於A、AmBn、B三種晶體同時存在的非平衡狀態。若二元化合物在低共熔溫度以下只是在TD以上發生分解,而在低溫時卻是穩定的,其相圖便如圖所示。
3、具有多晶轉變的二元系統相圖
二元系統中某組元或化合物具有多晶轉變時,相圖上該組元或化合物所對應的相區內便會出現一些新的界線,把同一種物質的不同晶型穩定存在的範圍劃分開來,使該物質的每一種穩定晶型都有其存在的相區。
根據晶型轉變溫度(TP)與低共熔溫度(TE)的相對高低,此類相圖又可分為兩種類型。
(1)TP>TE
多晶型轉變溫度高於低共熔溫度,說明多晶轉變是在有液相存在時發生的。下圖為此類型的相圖,圖中組元A有α和β兩種晶型,其中Aα相在TP溫度以上穩定,而Aβ相在TP溫度以下穩定,發生晶型轉變的溫度為TP。P點稱為多晶轉變點,由於系統中三相平衡共存,F=0,所以多晶轉變點也是二元無變數點。通過多晶轉變點P的水平線DP,稱為晶型轉變的等溫線,它把Aα和Aβ穩定存在的相區劃分開來。可以看出,當液相點達到P點後,系統為無變數,液相組成不能變,系統溫度也不能變。除此之外,實際上,這時的液相量亦不改變,因為液相剛到P點時,固相點在D點,晶型轉變結束,液相要離開P點時,固相點仍然在D點,根據槓桿規則可以很容易地看出晶型轉變過程中液相量不變,因此,晶型轉變點一定不會是結晶的結束點。
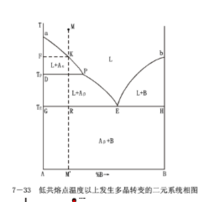
(2)TP<TE
多晶轉變溫度低於低共熔溫度,說明多晶轉變是在固相中發生的,下圖是這種類型的相圖。圖中P點為組元A的多晶轉變點,顯然在A-B二元系統中的純A晶體在TP溫度下都會發生這一轉變,因此P點發展為一條晶型轉變等溫線。在此線以上的相區,A晶體以α形態存在,此線以下的相區,則以β形態存在,此時P=3,F=0,為無變數過程。
4、形成固溶體的二元系統相圖
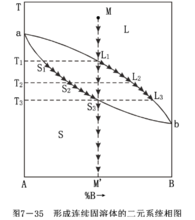
(1)形成連續固溶體的二元系統相圖
溶質和溶劑能以任意比例相互溶解的固溶體稱為連續(也稱為完全互溶或無限互溶)固溶體。形成連續固溶體的二元系統相圖如下圖所示。由於組元A和B在固態和液態下都能以任意比例互溶而不生成化合物,在相圖中沒有低共熔點也沒有最高點,因而液相線和固相線都是平滑連續曲線。
(2)形成不連續固溶體的二元系統相圖
溶質只能以一定的限量溶入溶劑,超過限度便會出現第二相,這種固溶體稱為不連續(也稱為部分互溶或有限互溶)固溶體。在A、B兩組元形成有限固溶體系中,以SA(B)表示B組元溶解在A晶體中所形成的固溶體,SB(A)表示A組元溶解在B晶體中所形成的固溶體,根據無變數點性質的不同,這類相圖又可分為具有低共熔點的和具有轉熔點的兩種類型。
具有低共熔點的有限固溶體的二元系統相圖
如圖所示,圖中aE線是與SA(B)固溶體平衡的液相線。bE線是與SB(A)固溶體平衡的液相線。aC和bD是兩條固相線。E點是低共熔點,從E點液相中將同時析出組成為C的SA(B)和組成為D的SB(A)固溶體,其相平衡方程為:LE↔SA(B)+SB(A)C點表示了組元B在組元A中的最大固溶度,D點則表示了組元A在組元B中的最大固溶度。CF是固溶體SA(B)的溶解度曲線,DG則是固溶體SB(A)的溶解度曲線,從這兩條曲線的走向可以看出A、B二個組元在固態互溶的溶解度是隨溫度下降而下降的。相圖中的六個相區裡有三個單相區和三個兩相區。
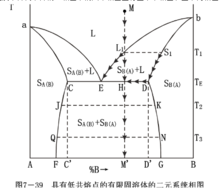
將熔體M冷卻到T1溫度,液相對固溶體SB(A)飽和,並從L1液相中析出組成為S1的熔體SB(A)。繼續冷卻,液相點沿著液相線向E點移動,固相點沿著固相線從S1向D點移動。到達低共熔溫度TE時,進行低共熔過程,從液相LE中同時析出組成為C的固溶體SB(A)和組成為D的固溶體SA(B)系統進入三相平衡狀態,F=0,系統溫度和液相組成均保持不變。但液相量在不斷減少,SA(B)和SB(A)的量在不斷增加,由於有S(B)析出,所以固相組成要由D向H點移動,當固相組成到達H點與系統的狀態點重合時,最後一滴液相在E點消失,結晶結束。最後的析晶產物是SA(B)和SB(A)兩種固溶體。溫度繼續下降時,SA(B)的組成沿CF線變化,SB(A)的組成沿DG變化,達到T3溫度時,SA(B)的組成為Q,SB(A)的組成為N,兩種固溶體的相對含量為:SA(B):SB(A)=ON:OQ。
 二元相圖
二元相圖