基本介紹
- 中文名:一氧化碳脫氫酶
- 外文名:carbon monoxide dehydrogenase,CODH
- 漢語拼音:yi yang hua tan tuo qing mei
- 學科領域:生物化學、微生物學、氣體酶學
- 主要作用:催化
- 類別:Mo—Fe一黃素酶類和Ni—Fe酶類
介紹,類型,含鉬,分子結構,活性中心,催化機理,抑制作用,含鎳,分類,活性中心,催化機理,
介紹
一氧化碳是大氣中危害很大的一種污染物。工業上煤不完全燃燒產生的廢氣,汽車的尾氣,以及火山爆發的氣體中都含有CO。據估計,全世界CO的年產量可高達(3.1×109)~(14.1×109)t。地球表面土壤的細菌在清除大氣中CO的過程中,發揮了非常重要的作用。這是因為這些細菌細胞記憶體在一大類一氧化碳脫氫酶(carbon monoxide dehydrogenase,CODH)。
一氧化碳脫氫酶是一大類存在於許多需氧和厭氧微生物中的脫氫酶,能夠催化一氧化碳氧化為二氧化碳的反應或其逆反應,在這些微生物的代謝途徑中起著關鍵作用。
CO+H2O⇌CO2+2H++2e-
不同來源的一氧化碳脫氫酶具有不同的結構和催化機理。
需氧細菌中的一氧化碳脫氫酶是一類含鉬(Mo)金屬蛋白,需氧細菌利用它們在呼吸作用中氧化一氧化碳來獲得能量。而厭氧微生物(包括厭氧細菌和古菌)中的一氧化碳脫氫酶則屬於含鎳(Ni)金屬蛋白,在不同種屬的微生物中發揮不同的作用。特別在厭氧微生物固定一氧化碳和二氧化碳的Wood—Ljungdahl代謝途徑中,一氧化碳脫氫酶可以與乙醯輔酶A合成酶(同為鎳蛋白)結合形成雙功能酶,共同發揮作用,將一氧化碳和二氧化碳轉化為重要的代謝中間物乙醯輔酶A。由於一氧化碳脫氫酶能夠高效地催化對動物和人體有很高毒性的一氧化碳氧化為二氧化碳,因此對於其催化機理的研究有助於治理環境中的一氧化碳污染。
類型
一氧化碳脫氫酶分為兩大類:存在於需氧微生物中的Mo—Fe一黃素酶類和存在於厭氧微生物中的Ni—Fe酶類。由於組成這兩類金屬酶活性中心、起關鍵作用的金屬分別是鉬和鎳,因此,這兩類酶分別稱為含鉬一氧化碳脫氫酶——(Mo—CODH)和含鎳一氧化碳脫氫酶——(Ni—CODH)。Mo—CODH對CO有很高的親和力,適合於除去環境中痕量的一氧化碳氣體;而就催化活性而言,Ni—CODH則是Mo—CODH的近1 000倍。
含鉬
自然界的一氧化碳自養菌(carboxydotrophs)中存在含鉬一氧化碳脫氫酶(Mo—CODH),它是一類含鉬的鐵硫黃素蛋白。
在一氧化碳自養菌中,除少數Mo—CODH定位於細胞質外,大多數Mo—CODH都連線在細胞質膜的內表面上,從而有利於其與同樣連線在內膜上的電子受體——細胞色素b561之間進行電子傳遞。在Mo—CODH中,Mo結合在鉬喋呤胞嘧啶二核苷酸(MCD)輔助因子上。
業已發現,在嗜溫菌食羧寡氧菌(Oligotropha carboxidovorans)和嗜熱菌高溫食羧寡氧菌(Oligotropha thermocarboxidovorans)中,Mo—CODH的相對分子質量為230 000~310 000,由相同的亞基組成。下面重點介紹迄今研究最多的食羧寡氧菌的Mo—CODH。
分子結構
天然的Mo—CODH是一個二聚體,每個單體是由L、M和s三個亞基組成的LMS複合物。L、M和S亞基分別由809、288和166個胺基酸組成,其相對分子質量分別為88 700、30 200和17 800。Mo—CODH的整體結構如圖1所示。
 圖1 Mo—CODH的整體結構圖
圖1 Mo—CODH的整體結構圖Mo—CODH的L亞基又稱為鉬蛋白(molybdoprotein),含有鉬和與之結合的MCD,其中鉬離子與另一金屬離子銅離子形成活性中心的[ CuSMoO2]簇;M亞基為黃素蛋白,其中含有黃素腺嘌呤二核苷酸(FAD);S亞基屬於鐵硫蛋白,結合了兩個[ 2Fe一2S ]簇。s亞基從結構上可以分為N端和C端兩個結構域,這兩個結構域各結合了一個[2Fe一2S]簇。M亞基由N端、中間和C端三個結構域組成。其FAD分子的結合位點有兩段特徵性的“雙甘氨酸(double—glycine)”序列。
L亞基不僅包含有活性中心,也在LMS複合物形成及Mo—CODH二體化中起主要作用。L亞基含有N端結構域和C端結構域,而鉬原子就定位在這兩個結構域的結合面上。MCD輔助因子的一端連線Mo的部分與活性中心的[CuSMoO2]簇一起結合在N端結構域的凹槽中;而輔助因子的另一端則插入C端結構域的裂縫中。L亞基的N端結構域與M和s亞基相互作用以形成LMS複合物;而C端結構域則主要參與形成Mo—CODH二聚體結構。 ’
活性中心
Mo—CODH的活性中心位於L亞基,並被包埋於蛋白質內部。但是,從外部可以通過一個約1.7nm長的通道到達活性中心。這個通道由疏水殘基構成,從而允許CO分子進入,而又能阻止極性溶劑分子(如水分子)進入。近期的研究表明,Mo—CODH的活性中心是一個Cu—Mo金屬簇,其包含有一個Cu離子和一個[MoO2],Cu離子和Mo離子之間通過一個配位硫原子(μS,又稱為硫橋)來連線,結合在Cys388的Sγ原子上,將此金屬簇[CuSMoO2]與L亞基共價連線的是Cu而不是Se。而MCD是通過其上的兩個S原子與Mo離子形成配位鍵。這種由Mo和Cu兩種金屬組成的雙核金屬簇非常獨特,因為所有已知的鉬蛋白或MCD的Mo金屬蛋白中都是單核的。
Mo—CODH的每個單體都是一個完整的催化單元,可以獨立地進行催化反應。
催化機理
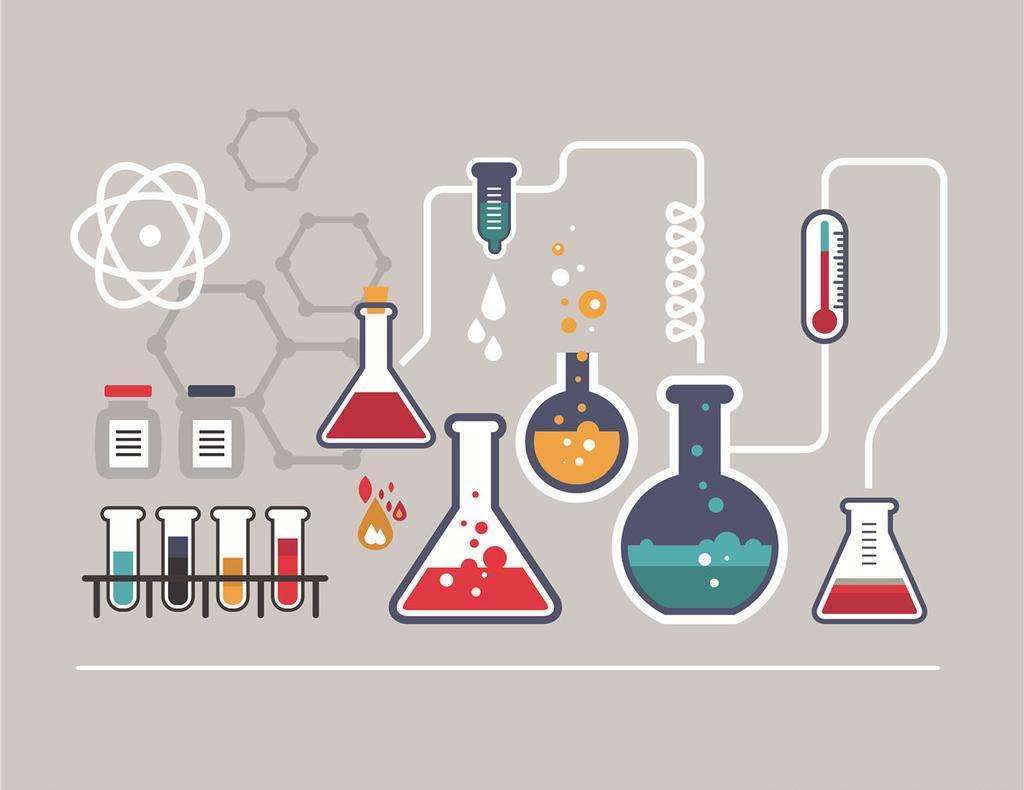
研究不同狀態下活性中心的結構變化,可以推測整個催化過程:處於氧化態的Mo(+VI價)離子與MCD上的兩個硫原子以及0a和Ob形成扭曲的金字塔形的四配位結構;當CO結合上後,CO與硫橋、0b以及銅離子連線並處於同一平面上,鉬離子被還原為+Ⅳ價,Mo與Oa之間距離縮短,可能形成了三鍵連線;在H20分子的攻擊下,CO2和H+被釋放出來,Mo與Oa之間回到雙鍵連線,而Ob變為OH基團與鉬離子之間形成單鍵連線,整個活性中心處於還原態;將兩個電子傳遞給鐵硫簇Ⅱ後,活性中心又重新回到氧化態,從而完成一輪催化過程(圖2)。
 圖2 Mo—CODH的催化機理
圖2 Mo—CODH的催化機理抑制作用
Mo—CODH很容易被氰化物所抑制,這種抑制主要是通過氰化物與[CuSMoO2]簇的硫橋和銅離子反應生成游離的硫氰離子(SCN-)和氰化銅(CuCN)來使活性中心失活。
含鎳
含鎳一氧化碳脫氫酶(Ni—CODH)廣泛存在於以一氧化碳為碳源和能源的厭氧微生物中,如乙酸生成細菌(acetogenic bacteria)、光養細菌(phototrophic bacteria)、氫氣生成細菌(hydrogenogenic bacteria)、硫酸還原細菌和古菌(sulfate—reducing bacteria and archaea)以及甲烷生成古菌(methanogenic archaea)等。
Ni—CODH在活性位點處的關鍵金屬為Ni,負責電子傳遞的鐵硫簇為[4Fe一4S]而非[2Fe一2S],而且沒有發現有像Mo—CODH中的FAD和MCD輔助因子,整體結構上也沒有相似性。不同來源的Ni—CODH差別很大:既有單功能的一氧化碳脫氫酶只負責催化CO的氧化;又有雙功能酶,即同時具有一氧化碳脫氫酶和乙醯輔酶A合成酶(ACS)的活性,生理狀態下需要Ni—CODH與ACS結合共同發揮功能。因此,又常常以CODH/ACS複合物的名稱來代替Ni—CODH。
分類
根據催化活性、代謝功能和蛋白性質和組成的不同,可以將CODH/ACS分為以下四類:
(1)第一類存在於專性化能自養的甲烷生成菌,負責直接利用CO2和氫氣(H2)來合成乙醯輔酶A。
(2)第二類酶則負責與第一類相反的反應,即將乙醯輔酶A分解為CO2和CH4,主要存在於利用乙酸的甲烷生成古菌和硫酸還原菌中。
(3)第三類CODH/ACS存在於乙酸生成細菌中,其作用與第一類酶相同,只是以丙酮酸鹽作為Co2和H2的來源,並參與Wood—L jungdahl途徑。圖3顯示第三類Ni—CODH/ACS整體結構及各金屬簇位置。
(4)第四類酶是一類單功能酶.只負責催化CO的氧化。
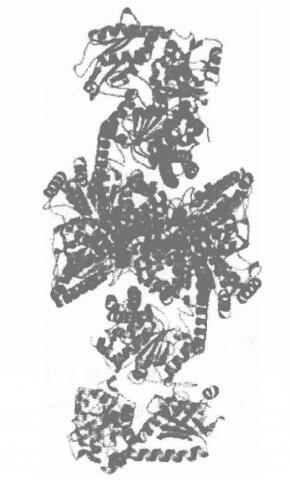 圖3 第三類Ni-CODH/ACS整體結構及各金屬簇位置
圖3 第三類Ni-CODH/ACS整體結構及各金屬簇位置活性中心
除第四類CODH/ACS外,其他三類酶都是雙功能酶,甚至多功能酶。因此,這三類酶具有兩個或多個活性中心。其中,兩個核心反應,即CO的氧化和乙醯輔酶A的合成,對應的活性中心金屬簇分別為C簇和A簇。其中,C簇位於α亞基(第三類CODH/ACS中為β亞基),其組成為[Ni-4Fe一4S]或[Ni一4Fe一5S];而A簇位於β亞基(第三類CODH/ACS中為α亞基)。A簇和C簇之間通過一個疏水通道相連,從而可以相互傳遞催化產物。此外,α亞基(第三類CODH/ACS中為β亞基)二聚體中還含有5~7個鐵硫簇[4Fe一4S],負責電子傳遞。
催化機理
負責CO的氧化的活性中心C簇的催化機理主要由兩步反應組成。第一步,CO被氧化,而C簇被還原;第二步,電子從C簇傳遞到蛋白外的電子受體,如鐵氧化還原蛋白(ferredoxin),C簇回到初始狀態。在這一過程,C簇中存在四種氧化還原態:Cox,Cred1,Cint和Cred2。其中,處於氧化狀態(Ni2+一Fel 3+)的Cox在獲得一個電子之後轉化為Cred1。Cred1是與CO和OH基團結合時C簇的狀態;而Cred2出現在Credl之後,此時CO可能已被氧化為CO2,並釋放出H+離子。這步反應可能是由OH基團攻擊連線在Ni上的CO引發,因為在C簇周圍有多個鹼性殘基(包括一個賴氨酸和多個組氨酸),使結合在Fel上的水分子的pKa顯著降低,從而使水分子轉變為活性的OH基團,對CO進行攻擊。此外,在C簇附近還有一個保守的天冬氨酸,可以與組氨酸形成氫鍵連線,促進此酸鹼反應的發生。反應生成的H+通過組氨酸形成的質子通道傳遞到外部溶劑中。CO被氧化為CO2後,C簇接受兩個電子從Cred1轉變為Cred2,隨後兩個電子一個接一個地被傳遞到B簇。傳走第一個電子後,C簇轉化為中間態Cint;兩個電子都傳到B簇後,C簇又重新轉化為Cred1,從而完成一次催化循環。