基本介紹
- 中文名:五氧化二氮
- 別稱:硝酐
- 化學式:N2O5
- 分子量:108
- CAS登錄號:10102-03-1
- 沸點:32℃
- 水溶性:微溶於水
- 密度:2.05 g/cm3
- 外觀:無色柱狀結晶體
- 危險性描述:遇高溫或可燃性物質能引起爆炸
- 毒性:劇毒
簡介
分子結構
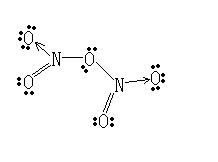 N2O5的結構
N2O5的結構
N2O5一般指本詞條
 N2O5的結構
N2O5的結構五氧化二氮分子是平面形分子,分子中存在離域π鍵。 N2O5的結構 五氧化二氮分子中主要為sp2雜化,含有6個σ鍵和2個三原子四電子離域π鍵。因此圖中四個氧原子(...
例如碳(酸)酐即二氧化碳CO2、硝(酸)酐即五氧化二氮N2O5。(2)有機酸的酸酐,由兩個一元酸分子或一個二元酸分子縮水而成的化合物,雖不是氧化物,也稱酸酐。例如...
6,15-二氫羥基-5,9,14,18-二蒽並[1,2-1',2']噠嗪是一種化學物質,化學式是C28H14N2O5,分子量是458.42。中文名 6,15-二氫羥基-5,9,14,18-二蒽...
N-(5-甲氨基-2-噻吩甲醯基)-L-谷氨酸二乙酯是一種化學物質,分子式是C15H22N2O5S。...... 噻吩甲醯基)-L-谷氨酸二乙酯是一種化學物質,分子式是C15H22N2O5...
吡諾克辛(Pirenoxine),別名白內停酸,是一種化學品。化學名稱1-羥基-5-氧-5H-吡啶並-[3,2-a]-吩噁嗪-3-羧酸,分子式為C16H8N2O5,分子量為308.24500。吡...
二硝基酚,2,4-dinitrophenol;Aldifen,別名2,4-二硝基酚。分子式C6H4N2O5;HOC6H3(NO2)2外觀與性狀淡黃色固體 分子量184.11沸點升華 熔點112~114℃溶解性不溶...
氮氧化物,包括多種化合物,如一氧化二氮(N2O)、一氧化氮 (NO)、二氧化氮(NO2)、三氧化二氮 (N2O3)、四氧化二氮(N2O4)和五氧化二氮(N2O5)等。除二氧化氮以...
按乾燥品計算,含氯黴素(C11H12Cl2N2O5) 應為75.0%~79.0%。本品為白色或類白色的結晶性粉末;無臭,味苦。本品在乙醇或丙酮中易溶,在水中微溶;在鹼溶液中...
去氧氟尿苷(Doxifluridine)是一種白色固體的化學品,別名:多西氟尿啶,化學式為C9H11FN2O5,分子量為246.19200,熔點188~192℃。去氧氟尿苷臨床上口服主要用於治療...
喹那普利化學名為S-2[N-[(S)-1-乙氧羰基-3-苯丙基]-L-丙氨醯]-1,2,3,4-四氫-3-異喹啉酸鹽,是分子式為C25H30N2O5,熔點在120-130°C之間的白色...
氨氯地平(amlodipine)化學名為6-甲基-2-(2-氨基乙氧基)甲基-4-(2-氯苯基)-1,4-二氫-3,5-吡啶二甲酸甲乙酯,黃色固體,分子式為C20H25ClN2O5,分子量為...
馬來酸左旋氨氯地平是一種化學物質,分子式是C20H25ClN2O5 ·C4H6O4。...... 馬來酸左旋氨氯地平是一種化學物質,分子式是C20H25ClN2O5 ·C4H6O4。...
1S/C39H34N2O5/c42-36(41-39(27-14-4-1-5-15-27,28-16-6-2-7-17-28)29-18-8-3-9-19-29)24-30(25-37(43)44)40-38(45)46-26-35-33-22...
鹽酸達泊西汀是一種化學物質,分子式是C9H7ClN2O5,分子量341.15。...... 鹽酸達泊西汀是一種化學物質,分子式是C9H7ClN2O5,分子量341.15。中文名 鹽酸達泊西...
異硬脂醯胺丙基嗎啉乳酸鹽是一種化學物質,化學式是C28H56N2O5,分子量為500.75464。...... 異硬脂醯胺丙基嗎啉乳酸鹽是一種化學物質,化學式是C28H56N2O5,分子量...
6.4.1 N2O5硝化技術6.4.2 芳烴的綠色硝化和選擇性硝化6.4.3 TNAZ的綠色製造技術參考文獻第7章 綠色環化反應與技術7.1 概述7.2 脫水縮合環化反應7.2.1 醛...
氮氧化合物(nitrogen oxide)包括一氧化氮(NO)、一氧化二氮(N2O,笑氣)、二氧化氮(NO2)、三氧化二氮(N2O3)、四氧化二氮(N2O4)及五氧化二氮(N2O5)等。除...
