基本介紹
簡介,特點,
簡介
由於這種特異性,使caspase能夠高度選擇性地切割某些蛋白質,這種切割只發生在少數(通常只有1個)位點上,主要是在結構域間的位點上,切割的結果或是活化某種蛋白,或使某種蛋白失活,但從不完全降解一種蛋白質。
Caspase的研究源於線蟲(C. elegans)細胞程式化死亡的研究。線蟲在發育過程中,有131個細胞將進入程式化死亡;研究發現有11個基因與PCD有關,其中ced3和ced4基因是決定細胞凋亡所必需的,ced9基因抑制PCD。線蟲細胞程式化死亡的研究促進了其他動物特別是哺乳類動物中細胞凋亡的研究。人們發現哺乳類細胞中存在著Ced3的同源物ICE(interleukin-1b converting enzyme),它催化白介素-1b的活化,即從其前體上將IL-1b切割下來。在大鼠成纖維細胞中過量表達ICE和Ced3都會引起細胞凋亡,表明了ICE和Ced3在結構和功能上的相似性;然而敲除ICE基因的小鼠其表現型正常,並未發現細胞凋亡發生明顯改變。進一步的研究發現,另一個ICE成員,後來被稱為apopain,CPP32或Yama的半胱氨酸蛋白酶,催化poly(ADP-ribose)Polymerase(PARP),即聚(ADP-核糖)聚合酶的裂解,結果導致細胞的凋亡, 因而認為apopain執行著與線蟲中的ced3相同的功能。Apopain被稱為是“死亡酶”, 而PARP被認為是“死亡底物”。 Apopain/CPP32/Yama是在1995年由兩個實驗室分別同時報導,時間上只有兩周之差。Ced4的哺乳類同源物則遲遲未能發現,直到1997年,才被證明是Apaf-1(即一種細胞凋亡蛋白酶活化因子apoptosis protease activating factor)。而Ced 9的哺乳類對應物則較早地被證明是BCL-2,這一問題將在以後的部分述及。
特點
現已確定至少存在11種caspase:
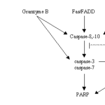
這些caspases中,caspase 1和caspase 11,以及可能還有caspase 4被認為不直接參與凋亡信號的轉導,它們主要參與白介素前體的活化;而caspase 2,caspase 8,caspase 9和caspase 10參與細胞凋亡的起始;參與細胞凋亡執行的則是caspase 3,caspase 6和caspase 7,其中caspase 3和7具有相近的底物和抑制劑特異性,它們降解PARP,DFF-45(DNA fragmentation factor-45),導致DNA修復的抑制並啟動DNA的降解。而caspase-6的底物是lamin A和keratin 18,它們的降解導致核纖層和細胞骨架的崩解。
一般的蛋白酶活化時,只是將N-末端的肽段切除,而caspase的活化則需在兩個亞基的連線區的天冬氨酸位點進行切割,結果產生了由兩個亞基組成的異二聚體,此即具有活性的酶。通常N-末端的肽在活化時也被除去,但對於caspase 7是否去除N-末端肽對活性無影響。目前認為細胞凋亡的起始者(caspase 2,8,9和10)和執行者(caspase 3,6和7)之間存在著上下游關係,即起始者活化執行者。
凋亡起始者(caspase 2,和10)的活化屬於同性活化(Homo activation)。caspase 8和10含有串聯重複的“死亡效應子”結構域(death effector domain,DED),而caspase 2和9則含有不同但類似的caspase募集結構域(caspase recruitment domain CARD),這兩種結構域是募召caspase 2,8和10所必需的。
caspase-8終止凋亡, is able to cleave RIP1 andRIP3, effectively terminating necrosis。