CaMV35S啟動子是指來自花椰菜花葉病毒( CaMV )的35S啟動子。這種啟動子在植株被CaMV感染期間,指導35S RNA合成,並且使之在許多雙子葉植物的組織中高效表達,但它是單子葉植物的一種較弱的啟動子。CaMV35S啟動子作為一種組成型啟動子在所有組織中都能啟動基因的表達,具有持續性,不表現時空特異性;RNA和蛋白質表達量也相對恆定。
基本介紹
- 中文名:CaMV35S啟動子
- 外文名:the cauliflower mosaic virus 35S promoter
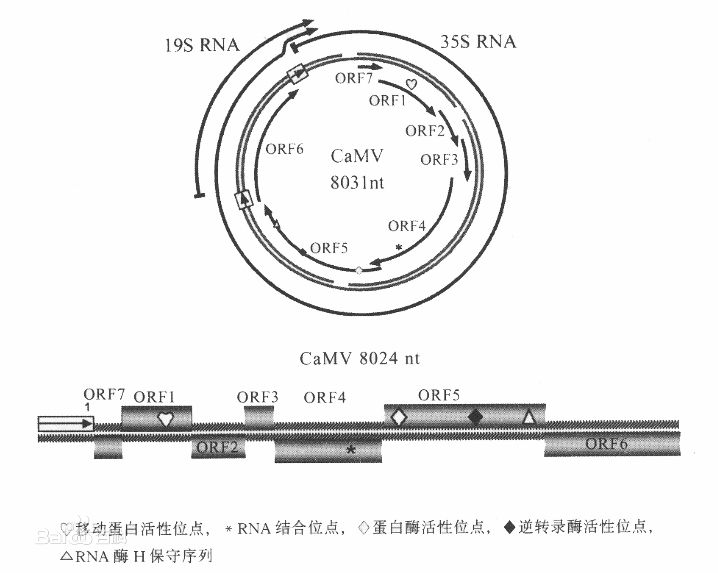
CaMV35S啟動子是指來自花椰菜花葉病毒( CaMV )的35S啟動子。這種啟動子在植株被CaMV感染期間,指導35S RNA合成,並且使之在許多雙子葉植物的組織中高效表達,但它是單子葉植物的一種較弱的啟動子。CaMV35S啟動子作為一種組成型啟動子在所有組織中都能啟動基因的表達,具有持續性,不表現時空特異性;RNA和蛋白質表達量也相對恆定。
CaMV35S啟動子是指來自花椰菜花葉病毒( CaMV )的35S啟動子。這種啟動子在植株被CaMV感染期間,指導35S RNA合成,並且使之在許多雙子葉植物的組織中高效表達,但它...
目前使用最廣泛的組成型啟動子是花椰菜花葉病毒(CaMV)35S 啟動子、來自根癌農桿菌Ti 質粒T-DNA 區域的胭脂鹼合成酶基因nos 啟動子,後者雖來自細菌,但具有植物...
因此許多早期的組成型啟動子都來源於植物病毒並且至今仍舊被廣泛使用。例如目前最廣泛使用的花椰菜花葉病毒CaMV35S啟動子。該啟動子轉錄調控區全長只有3Kb,更短的...
Mandel等人利用CaMV35S啟動子使AP1 基因在擬南芥組成型中表達,轉基因擬南芥開花時間早於野生型。此後,Weigel等和Sarah等驗證了 35S::AP1 轉基因植株不論在長日照...
一般情況下,篩選檢測以啟動子、終止子等通用元件為檢測對象,初步判斷是否含有外源基因。番木瓜轉基因成分篩查通常以CaMV35S啟動子、NOS-P、NOS終止子等元件為靶序列...
法呢基焦磷酸合酶(farnesyl diphosphate synthase,fps)的cDNA插入載體,構建CaMV35S啟動子驅動下的植物表達載體pBinARfps。...
1999年,Meyer等[38]採用CaMV35S啟動子,用農桿菌介導胡蘿蔔AFP基因重組子轉化擬南芥,轉基因植物提取液有明顯的抗凍活性,能夠修飾冰晶形態,表明抗凍活性與AFP基因轉錄...
研究發現,將硝酸還原酶基因連線在CaMV35S啟動子下構成組成型表達轉入菸草中,光照或者56h黑暗處理後,轉基因菸草硝酸還原酶mRNA水平高達野生型的5倍,硝酸還原酶蛋白...
經農業部農產品質量監督檢驗測試中心(瀋陽)檢測,該品系中未檢出CaMV35S啟動子,、NOS終止子、Bt終止子、Bt基因、BAR基因、Cp4-cpsps、35S-CTP4,檢驗結果為陰性...
經農業部農產品質量監督檢驗測試中心(瀋陽)檢測,該品系中未檢出CaMV35S啟動子、NOS終止子、Bt終止子、Bt基因、BAR基因、Cp4-epsps、35S-CTP4,檢測結果為陰性。...
經農業部農產品質量監督檢驗測試中心(瀋陽)檢測,該品系中未檢出CaMV35S啟動子、NOS終止子、Bt終止子、Bt基因、BAR基因、Cp4-epsps、35S-CTP4,檢測結果為陰性。...
經農業部農產品質量監督檢驗測試中心(瀋陽)檢測,該品系中未檢出CaMV35S啟動子、NOS終止子、Bt終止子、Bt基因、BAR基因、Cp4-epsps、35S-CTP4,檢測結果為陰性。...
經農業部農產品質量監督檢驗測試中心(瀋陽)檢測,該品系中未檢出CaMV35S啟動子、NOS終止子、Bt終止子、Bt基因、BAR基因、Cp4-epsps、35S-CTP4,檢測結果為陰性。...
經農業部農產品質量監督檢驗測試中心(瀋陽)檢測,該品系中未檢出CaMV35S啟動子、NOS終止子、Bt終止子、Bt基因、BAR基因、Cp4-epsps、35S-CTP4,檢測結果為陰性。...
