簡介
氯化鋁,化學式為AlCl
3,是
鋁的氯化物。氯化鋁熔點、沸點都很低,會升華,為共價化合物。熔化的氯化鋁不易導電,與大多數含
鹵素離子的鹽類(如
氯化鈉)不同。
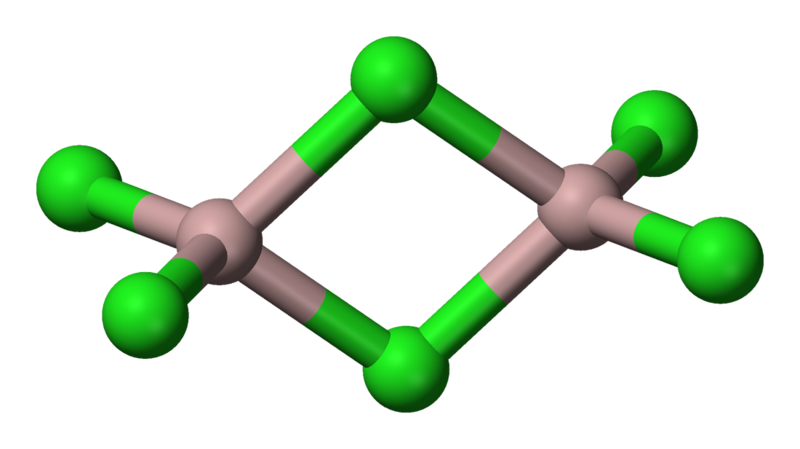
AlCl
3採取“YCl3”結構,為Al
3+立方最密堆積層狀結構,而AlBr
3中Al
3+卻占Br
−最密堆積框架的相鄰四面體間隙。熔融時AlCl
3生成可揮發的
二聚體Al
2Cl
6,含有兩個三中心四電子氯橋鍵,更高溫度下Al
2Cl
6二聚體則離解生成平面三角形AlCl
3,與
BF3結構類似。
氯化鋁是無色透明晶體或白色而微帶淺黃色的結晶性粉末。氯化鋁的蒸氣或溶於
非極性溶劑中或處於
熔融狀態時,都以
共價的二聚分子形式存在。可溶於水和許多有機溶劑。水溶液呈酸性。芳烴存在下,氯化鋁與鋁混合可用於合成二(芳烴)金屬配合物。例如,二苯鉻就是通過特定金屬鹵化物經由Fischer-Hafner合成製備的。
物理性質
氯化鋁,白色顆粒或粉末,有強鹽酸氣味,工業品呈淡黃色。易溶於水、醇、
氯仿、
四氯化碳,微溶於
苯。熔化的氯化鋁不易導電,和大多數含鹵素離子的鹽類(如
氯化鈉)不同。氯化鋁的水溶液完全解離,是良好的導電體。
 氯化鋁
氯化鋁無水氯化鋁在178℃升華,它的蒸氣是締合的雙分子。在空氣中能吸收水分,一部分水解而放出氯化氫。
AlCl
3採取“YCl
3”結構,為Al立方最密堆積層狀結構, 而AlBr
3中Al卻占Br最密堆積框架的相鄰四面體間隙。熔融時AlCl
3生成可揮發的
二聚體(AlCl
3)
2,含有兩個三中心四電子氯橋鍵,更高溫度下(AlCl
3)
2二聚體則離解生成平面三角形AlCl
3,與
BF3結構類似。
氯化鋁為無色透明晶體或白色而微帶淺黃色的結晶性粉末。極易吸收水分並部分水解放出
氯化氫而形成酸霧。易溶於水並強烈水解,溶液顯酸性。也溶於乙醇和
乙醚,同時放出大量的熱。六水合氯化鋁為無色斜方晶體,密度 2.398g/cm
3,100℃時分解。
化學性質
氯化鋁是強
路易斯酸, 可和
路易斯鹼作用產生化合物,甚至也可和
二苯甲酮和
均三甲苯之類的弱路易斯鹼作用。 若有氯離子存在,氯化鋁會生成四氯合鋁酸根離子(AlCl
4-):
在水中,氯化鋁會部分水解,形成氯化氫氣體或H
3O
+離子。其水溶液和其他含鋁物質的溶液相同,含有水合鋁離子,跟適當份量的氫氧化鈉反應可生成
氫氧化鋁沉澱:
Al2O3+3C+3Cl2=△=2AlCl3+3CO
2Al+3Cl
2=△=2AlCl
3  工業氯化鋁
工業氯化鋁AlCl3+4NaOH=NaAlO2+3NaCl+2H2O
氯化鋁容易潮解,由於水合會放熱,遇水可能會爆炸。它會部分水解,釋放氯化氫或
鹽酸。
溶液呈酸性,這是由於鋁離子部分水解造成的。
[Al(H
2O)
6]
3+ + H
2O ⇌ [Al(OH)(H
2O)
5]
2+ + H
3O
+主要用途
1.氯化鋁主要用在傅-克反應 中,例如以苯和光氣為原料製備蒽醌,套用於染整工業中。 在廣義的傅-克反應中,醯氯或鹵代烷和芳香族物質的反應式如右:
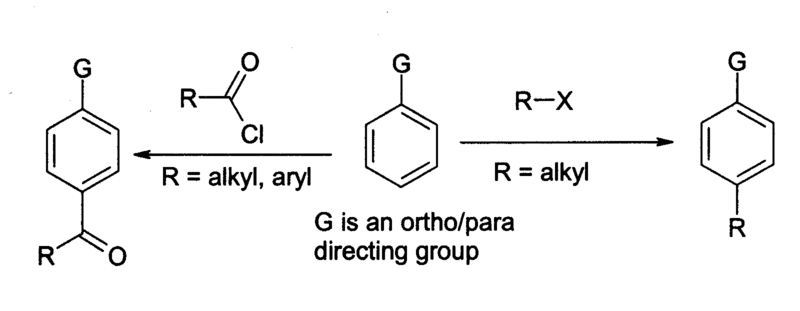
2.苯及其
衍生物在發生上述反應時,主產物是對位的異構物。相比較下,烷基化反應涉及的問題較多,不如醯基化反應套用廣泛。無論是哪種反應,氯化鋁和其他原料和儀器都必須是中等乾燥的,少量的水有助於反應進行。
由於氯化鋁可與反應產物配位,因此套用在傅克反應時,它的用量必須與反應物相同,而非“催化量”。反應後的氯化鋁很難回收,會產生大量的腐蝕性廢料。為了達到綠色化學的要求,化學家開始使用
氟化釔或
氟化鏑來替代氯化鋁,減少污染。
芳烴存在下,氯化鋁與鋁混合可用於合成二(芳烴)金屬配合物。例如,
二苯鉻就是通過特定金屬鹵化物經由Fischer-Hafner合成製備的。
低濃度的
鹼式氯化鋁常是防汗藥的成分之一,而
多汗症患者在使用時濃度會高些(12%或更高)。
5.用作有機合成的催化劑,如石油裂解、合成染料、合成橡膠、合成洗滌劑、醫藥、香料等;
6.用於製造農藥、有機鋁化合物、酞菁系有機顏料用催化劑、乙基苯製造用催化劑;
7.用於金屬冶煉、潤滑油合成;
8.食品級產品用作膨鬆劑、清酒等防變色劑及果膠的絮凝劑;
9.用作分析試劑、防腐劑、媒染劑。
製備方法
實驗室製法
實驗室用鋁和鹽酸在常溫條件下製備(2Al+ 6HCl == 2AlCl3 + 3H2↑)。在加熱條件下可以加速製備。
工業製法
工業上在常溫條件下用碳氯化法製取(Al2O3 + 3C + 3Cl2 =△= 2AlCl3 + 3CO)。
在常溫條件下也可用氧化鋁和四氯化碳反應製備(Al2O3 + 3CCl4 == 2AlCl3 + 3COCl2)。
無水氯化鋁在石油工業中及其他某些有機合成反應中用作催化劑。
金屬鋁法:將鋁錠放入密閉的氯化反應爐內,加熱並通氯氣進行氯化反應,生成的氯化鋁升華進入捕集器,經捕集,即製得氯化鋁成品;
化學反應式:2Al + 3Cl2 =點燃= 2AlCl3
2.鋁氧粉法:將一定粒度的工業氧化鋁與石油焦按一定比例投入焙燒爐內混合均勻,由爐底通入空氣進行焙燒。焙燒後的物料進入氯化爐,爐中通入氯氣和氧氣,鋁氧粉在還原劑炭的存在下與氯反應。生成的氣相產物經預冷、淨化去捕集器,製得氯化鋁成品。尾氣經氫氧化鈉或亞硫酸鈉溶液吸收處理後排空;
3.熔融法:將金屬鋁加熱熔融後通入無水氯化氫,而製得。
注意事項
無水氯化鋁會和
鹼劇烈反應,因此需妥善處理。含結晶水的氯化鋁較無此問題。
如果吸入無水氯化鋁或接觸眼睛和皮膚會造成刺激。
侵入途徑:吸入、食入、經皮吸收。
健康危害
吸入高濃度氯化鋁可刺激上呼吸道產生支氣管炎,並且對皮膚、黏膜有刺激作用,個別人可引起支氣管哮喘。誤服量大時,可引起口腔糜爛、胃炎、胃出血和黏膜壞死。
慢性作用:長期接觸可引起頭痛、頭暈、食慾減退、咳嗽、鼻塞、胸痛等症狀。
急性毒性:LD
503730mg/kg(大鼠經口);危險特性:遇水反應發熱放出有毒的
腐蝕性氣體;燃燒(分解)產物:
氯化物、
氧化鋁。
安全術語
S26不慎與眼睛接觸後,請立即用大量清水沖洗並徵求醫生意見。
S45若發生事故或感不適,立即就醫(可能的話,出示其標籤)。
S36/37/39穿戴適當的防護服、手套和護目鏡或面具。
安全措施
眼睛防護:戴化學安全防護眼鏡。
防護服:穿工作服(防腐材料製作)。
手防護:戴橡皮手套。
皮膚接觸:立即脫去污染的衣著,用大量流動清水徹底沖洗。
誤食入:患者清醒時立即漱口,給飲牛奶或蛋清。立即就醫。
防護措施 呼吸系統防護:可能接觸其粉塵時,應該佩帶防塵口罩。必要時佩帶防毒面具。
滅火方法:乾粉、砂土。禁止用水。
其它:工作後,淋浴更衣。單獨存放被毒物污染的衣服,洗後再用。保持良好的衛生習慣。
泄漏應急處理
隔離泄漏污染區,周圍設警告標誌,建議應急處理人員戴自給式呼吸器,穿化學防護服。不要直接接觸泄漏物,勿使泄漏物與可燃物質(木材、紙、油等)接觸,用清潔的鏟子收集於密閉容器中作好標記,等待處理。如果大量泄漏,最好不用水處理,在技術人員指導下清除。
急救措施
皮膚接觸:立即脫去污染的衣著,用大量流動清水徹底沖洗。
眼睛接觸:立即提起眼瞼,用流動清水沖洗10分鐘或用2%碳酸氫鈉溶液沖洗。
吸入:迅速脫離現場至空氣新鮮處。注意保暖,保持呼吸道通暢。必要時進行人工呼吸。就醫。
食入:患者清醒時立即漱口,給飲牛奶或蛋清。立即就醫。
滅火方法:乾粉、砂土。禁止用水。
 氯化鋁
氯化鋁 工業氯化鋁
工業氯化鋁


