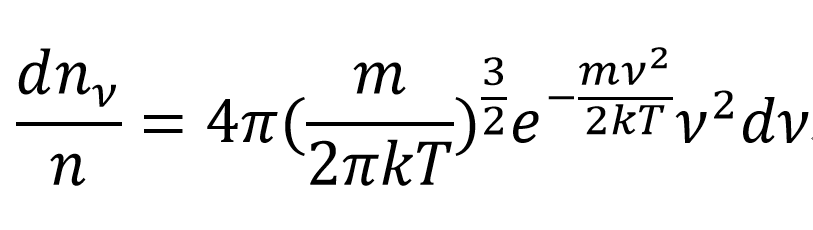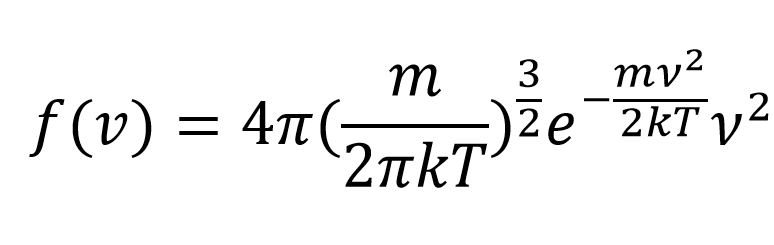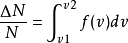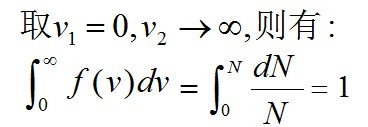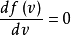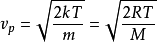定義
在平衡態下,理想氣體分子的速度分布是有規律的,這個規律稱為麥克斯韋速度分布律。如果不考慮分子的速度方向,只考慮速度的大小,即速率分布,則可稱為麥克斯韋速率分布律。麥克斯韋速率分布律是一個描述一定溫度下微觀粒子運動速度的機率分布,在物理學和化學中有套用。最常見的套用是在統計熱力學的領域。任何(巨觀)物理系統的溫度都是組成該系統的分子和原子的運動的結果。這些粒子有一個不同速度的範圍,而任何單個粒子的速度都因與其它粒子的碰撞而不斷變化。然而,對於大量粒子來說,如果系統處於或接近處於平衡,處於一個特定的速度範圍的粒子所占的比例卻幾乎不變。
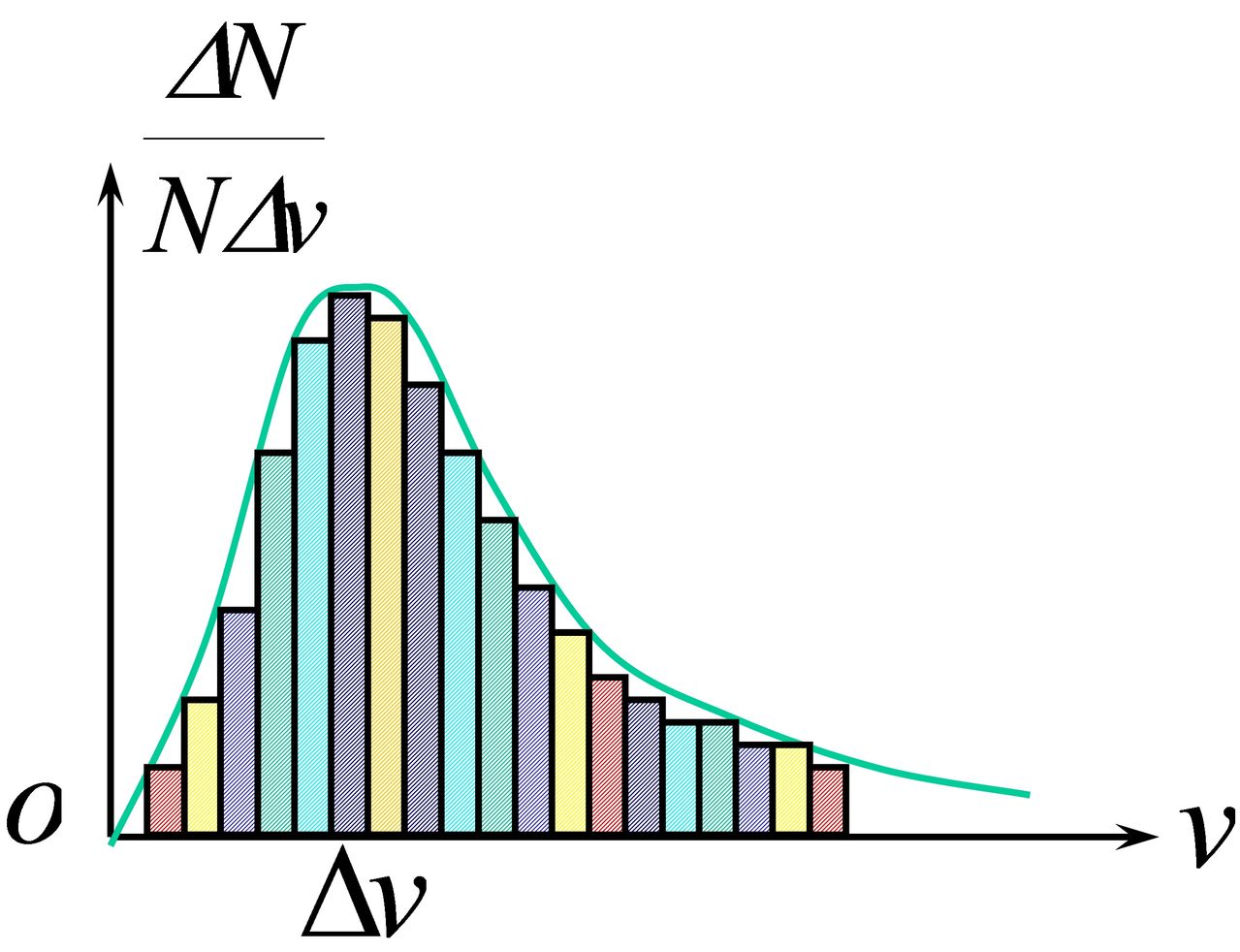
氣體中個別分子的速度具有怎樣的數值和方向完全是偶然的,但就大量分子的整體來看,在一定的條件下,氣體分子的速度分布也遵從一定的統計規律。這個規律也叫麥克斯韋速率分布律。
歷史
1859年,J.C.麥克斯韋首先獲得氣體分子速度的分布規律,爾後,又為L.玻耳茲曼由碰撞理論嚴格導出。因此,它也以詹姆斯.麥克斯韋和路德維希.玻爾茲曼命名。處於平衡狀態下的理想氣體分子以不同的速度運動,由於碰撞,每個分子的速度都不斷地改變,使分子具有各種速度。因為分子數目很大,分子速度的大小和方向是無規的,所以無法知道具有確定速度υ的分子數是多少,但可知道速度在υ1與υ2之間的分子數是多少。麥克斯韋首先得到,在平衡狀態下,氣體分子間相互作用可以忽略時,分布在任一速率區間υ~υ+dυ內的分子數與總分子數的比率。
內容
內容
在平衡態下,當氣體分子間的相互作用可以忽略時,分布在任一速率區間v~v+dv的分子數占總分子數的比率為:
麥克斯韋速率分布函式
速率分布函式
按統計假設,各種速率下的分子都存在,可以用某一速率區間內分子數占總分子數的百分比來表示分子按速率的分布規律。
1.將速率從0→∞分割成很多相等的速率區間。
例如速率間隔取100m/s ,整個速率分為0—100;100—200;…等區間。
2.總分子數為N,在v→v+△v區間內的分子數為△N
在v→v+△v區間內的機率為△Ni/N。則可了解分子按速率分布的情況。
3.機率
1)△Ni/N與v有關,不同v附近機率不同。
2)△Ni/N與△v有關,速率間隔大機率大。
4.v→dv速率間隔很小,
該區間內分子數為dN,在該速率區間內分子的機率dN/N∝dv寫成等式
f(v)=dN/Ndv
表示分布在v→v+dv區間內的分子數占總分子數的比率(或百分比)
速率分布函式的物理意義
表示在速率v附近,單位速率區間內分子出現的機率,或單位速率區間內分子數占總分子數的百分比。
在v→v+dv區間內的分子數為dN=Nf(v)dv
在v1→v2有限區間內的機率為
由於全部分子百分之百地分布在由0→
;的整個速率範圍內, 意義
1920年O.斯特恩最先用原子束(分子束)實驗直接驗證了麥克斯韋速率分布律的正確性。從麥克斯韋速率分布函式出發,可以求出氣體分子的最可幾速率、均方根速率和平均速率。
最概然速率
最概然速率是系統中任何分子最有可能具有的速率,對應於的最大值或
眾數。要把它求出來,我們計算速率分布函式的導數,設它為零,然後對它求解:
得出:
其中R是氣體常數,M=NAm是物質的摩爾質量。
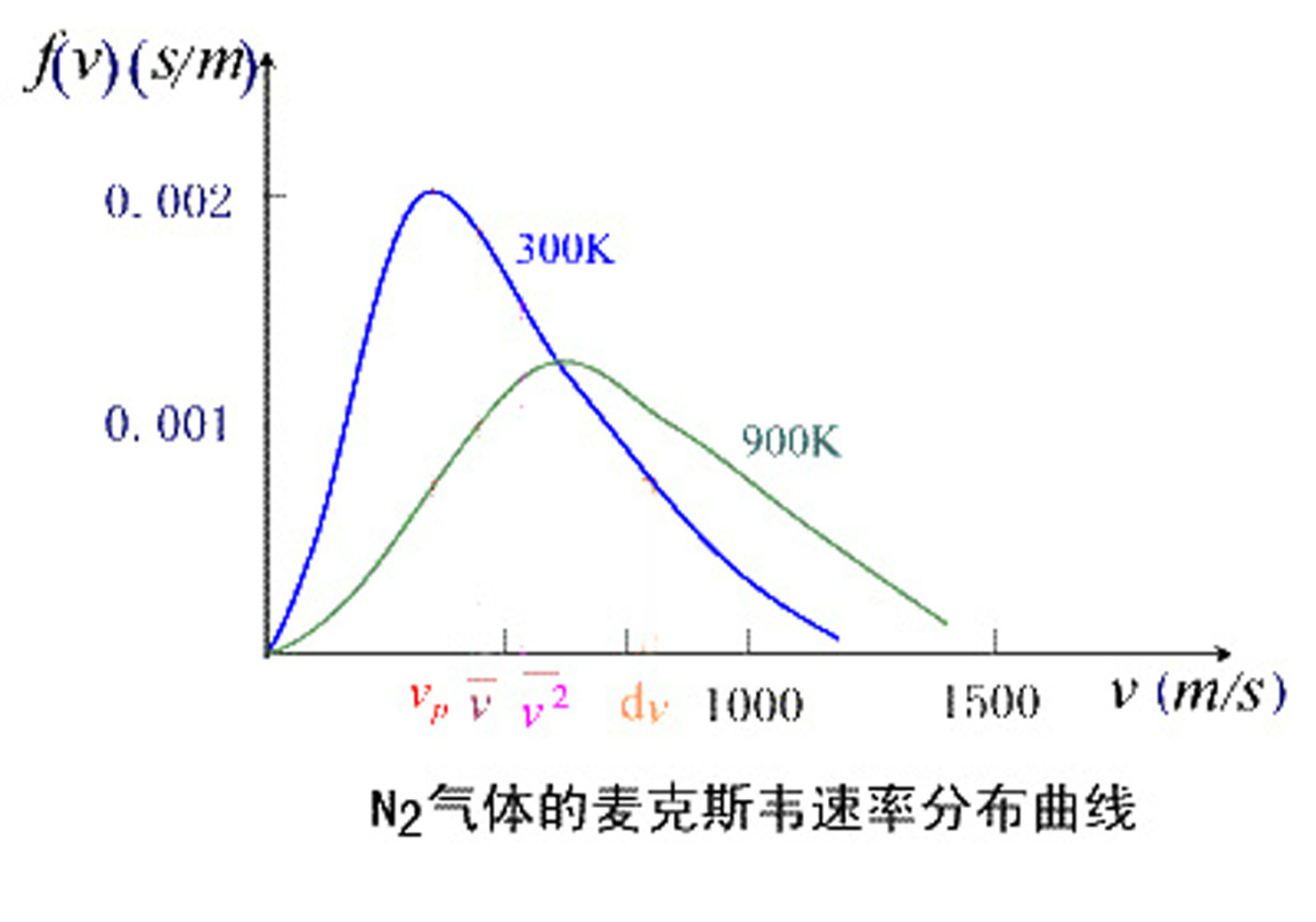
對於室溫(300K)下的氮氣(空氣的主要成分),可得
=422m/s。
平均速率
平均速率是速率分布的數學期望值:
方均根速率
方均根速率vrms是速率的平方的平均值的平方根:
三種典型速率的關係
它們具有以下的關係:
1872年,玻耳茲曼創立了系統的氣體輸運理論,從研究非平衡態分布函式著手,建立了
H定理(見
統計物理學)。玻耳茲曼根據
H定理證明,在達到平衡狀態時,氣體分子的速度分布趨於麥克斯韋分布。
套用
麥克斯韋速率分布律形成了分子運動論的基礎,它解釋了許多基本的氣體性質,包括壓強和擴散。麥克斯韋速率分布律通常指氣體中分子的速率的分布,但它還可以指分子的速度、動量,以及動量的大小的分布,每一個都有不同的機率分布函式,而它們都是聯繫在一起的。
麥克斯韋速率分布律可以用統計力學來推導(參見麥克斯韋-玻爾茲曼統計)。它對應於由大量不相互作用的粒子所組成、以碰撞為主的系統中最有可能的速率分布,其中量子效應可以忽略。由於氣體中分子的相互作用一般都是相當小的,因此麥克斯韋速率分布律提供了氣體狀態的非常好的近似。
在許多情況下(例如非彈性碰撞),這些條件不適用。例如,在電離層和空間電漿的物理學中,特別對電子而言,重組和碰撞激發(也就是輻射過程)是重要的。如果在這個情況下套用麥克斯韋速率分布律,就會得到錯誤的結果。另外一個不適用麥克斯韋速率分布律的情況,就是當氣體的量子熱波長與粒子之間的距離相比不夠小時,由於有顯著的量子效應也不能使用麥克斯韋速率分布律。另外,由於它是基於非相對論的假設,因此麥克斯韋速率分布律不能做出分子的速度大於光速的機率為零的預言。
還應當指出,麥克斯韋速率分布律只適用於處在平衡態的氣體;對於處在非平衡態的氣體,麥克斯韋速率分布律並不適用;對少量分子組成的系統,也不存在麥克斯韋速率分布律這樣的統計規律。儘管速率分布函式不能提供單個分子的詳細信息,但它是非常有用的。藉助它,我們可以計算出分子的平均速率及方均速率,從而計算出系統的巨觀量,如溫度或壓強。