基本介紹
- 中文名:鹵化磷
- 外文名:Phosphorus halide
- 分類:PX3、PX5、P2X4
三鹵化磷
五鹵化磷
四鹵化二磷
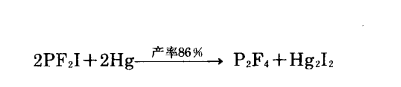 反應方程式
反應方程式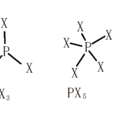
 反應方程式
反應方程式磷和鹵素可以形成多種磷鹵化合物,可稱作鹵化磷。在鹵化磷中,磷的化合價可以是+5、+3或+2價。除了PI5尚有爭議外,所有化合物都有了或詳或略的報導。混合...
1、能與氧氣劇烈反應,生成磷酸;與大部分鹵素反應,生成五鹵化磷,三鹵化磷的混合產物及氫鹵酸。2、通過灼熱金屬塊生成磷化物,放出氫氣: 。3、與銅、銀、金及...
鹵化反應又稱鹵代反應,是指有機化合物中的氫或其他基團被鹵素取代生成含鹵有機化合物的反應。常見的鹵化反應有烷烴的鹵化,芳烴的芳環鹵化和側鏈鹵化,醇羥基...
置換鹵化是以鹵化基置換有機物分子中其他基團的反應。與直接取代鹵化相比,置換鹵化具有無異構產物、多鹵化和產品純度高的優點,在藥物合成、染料及其他精細化學品...
《鹵化反應原理》是2017年化學工業出版社出版的圖書,作者是孫昌俊、房士敏,。...... 第一節鹵化氫或氫鹵酸與醇的反應112 第二節鹵化磷和三氯氧磷與醇的反應...
三鹵代磷PX3(X=Cl、Br、I)。五鹵化磷PX5(X=Cl、Br)和 鹵代反應 氯化亞碸等都是很強的鹵化試劑,醇與這些試劑作用可轉變為相應的鹵代物。這是實驗室中...
一般來說,磷胺中間體是不分離的。PPh3 + RN3 + H2O→OPPh3 + N2 + RNH2Cl2加入PPh3得到三苯基膦二氯([PPh3Cl]Cl),該試劑作為保濕敏感的鹵化膦存在,在有...
烴分子中的氫原子被鹵素原子取代後的化合物稱為鹵代烴(Haloalkane),簡稱鹵烴。...常用的試劑有氫鹵酸、鹵化磷及氯化亞碸(SOCl2,或稱亞硫醯氯)。A.醇與氫鹵...
醇與鹵化磷反應生成鹵代烷。醇羥基是一個不好的離去基團,與三溴化磷作用形成 ,Br進攻烷基的碳原子,-OPBr2作為離去基團離去。- OPBr2中還有兩個溴原子,可繼續...
利用氯氣或氯化物提煉某些金屬也稱氯化;在水中投氯或含氯氧化物以達到氧化和消毒...氯化劑氯化磷為氯化劑 用鹵化磷和醇反應是製備鹵代烴的好方法。用這一方法可...
9.1.5 醇與氫鹵酸的親核取代反應 /277 9.1.6 醇與三鹵化磷和五鹵化磷的反應 /279 9.1.7 醇與氯化亞碸的反應 /279 9.1.8 醇的脫水反應 /280 9.1.9 ...
能燃燒與氧氣生成十氧化四磷,五氧化二磷是其係數約分而來,在自然界不存在,紅磷都易與鹵素化合,生成三鹵化磷或五鹵化磷。穩定性:1、加熱至200℃則著火燃燒生成...
【不相容性】遠離氧化劑,鎂,鋁,醯鹵,酸酐,鹵化磷,亞硫醯氯化物和碳酸鹽。【穩定性】在正常的溫度和壓力穩定。【分解】有毒氣體。...
