鮑林近似能級圖外層電子鑽到內部空間而靠近原子核的現象,通常稱為鑽穿作用。
基本信息
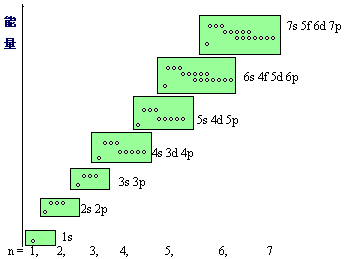 原子軌道近似能級圖
原子軌道近似能級圖鮑林近似能級圖外層電子鑽到內部空間而靠近原子核的現象,通常稱為鑽穿作用。
 原子軌道近似能級圖
原子軌道近似能級圖鮑林近似能級圖外層電子鑽到內部空間而靠近原子核的現象,通常稱為鑽穿作用。...... 鮑林近似能級圖外層電子鑽到內部空間而靠近原子核的現象,通常稱為鑽穿作用。...
在大量的光譜數據以及某些近似的理論計算的基礎上,美國化學家鮑林(Pauling)提出了多原子的原子軌道近似能級圖,圖中的能級順序是指電子按照能級從低到高在核外排布的...
1939年鮑林(L.Pauling)從大量光譜實驗數據中,總結出了在多電子原子中原子軌道能量高低的順序,並得出了鮑林的近似能級圖。鮑林近似能級圖 ...
所以,不能用鮑林近似能級圖來比較不同元素原子軌道能級的相對高低。(3)經進一步研究發現,鮑林近似能級圖實際上只反映同一原子外電子層中原子軌道能級的相對高低,而...
鮑林的近似能級圖 能級交錯同一電子層之間有電子的相互作用,不同電子層之間也有相互作用,這種相互作用稱為“鑽穿效應”。其原理較為複雜,鑽穿效應的直接結果就是...
1.5.1 鮑林近似能級圖1.5.2 科頓能級圖1.5.3 禁止和鑽穿1.6 基態原子的核外電子排布1.7 元素周期表1.8 原子參數1.8.1 原子半徑...
9.4.2 鮑林近似能級圖1929.4.3 核外電子排布規則1939.5 原子的電子結構與元素周期系1969.5.1 原子結構與元素周期表1969.5.2 元素性質的周期性197...
11.3.2 鮑林近似能級圖18411.3.3 多電子原子的核外電子排布規律18511.3.4 原子核外電子排布與元素周期律18711.4 主要原子參數及其變化規律189...
4 3 1鮑林原子軌道近似能級圖72閱讀材料禁止常數和軌道能量的計算734 3 2核外電子排布754 3 3元素周期表和原子的電子層結構76...
5.3.3 鮑林原子軌道近似能級圖5.3.4 原子核外電子排布的規則5.4 元素周期律5.4.1 原子的電子層結構和元素周期表5.4.2 元素性質的周期性習題...
6 3 1鮑林的原子軌道近似能級圖1146 3 2禁止效應和鑽穿效應 1156 3 3基態原子核外電子排布的原則1176 3 4基態原子中核外電子的分布1176 3 5原子的電子層...
