基本介紹
- 中文名:高矽氧玻璃
- 外文名:high-silica glass
- 發明人:美國康寧公司研究人員
製造原理
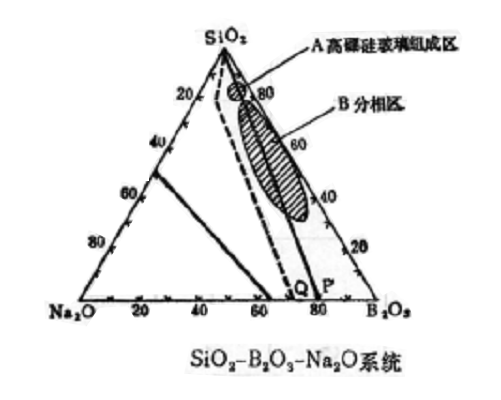 圖1
圖1
 圖1
圖1高矽氧玻璃是含二氧化矽(SiO2)高達96%以上的玻璃又稱96玻璃。1934年美國康寧公司研究人員在研究硼矽玻璃分相時發明了高矽氧玻璃,並於1939年以Vycor的商品名稱出售...
高矽氧纖維是高純氧化矽非晶體連續纖維的簡稱,其氧化矽含量96–98%,連續耐溫攝氏1000度,短暫耐溫攝氏1400度;其製成品主要包括連續紗、繩帶、套管、網布、縫編...
多孔高矽氧玻璃是一種用於從硝酸釷溶液中吸附233pa的吸附劑,具有很高的化學穩定性,熱穩定性和耐輻照穩定性,高導熱係數和很低的水浸出率。...
以高矽氧玻璃纖維為增強體、酚醛樹脂為基體進行複合得到的具有耐燒蝕防熱功能的複合材料。 套用學科 材料科學技術(一級學科),複合材料(二級學科),功能複合材料(三級...
中文名稱 高矽氧玻璃纖維增強體 英文名稱 refrasil fiber reinforcement 定義 將普通玻璃纖維經過酸瀝濾,濾出可溶性成分,使二氧化矽富集量達96%以上,再經熱燒結...
普通玻璃化學氧化物的組成(Na2O●CaO●6SiO2),主要成份是二氧化矽。廣泛套用於建築物,用來隔風透光。目錄 1 基本分類 2 石英玻璃系 3 高矽氧玻璃系 4 鈉...
高矽氧纖維是指用瀝取法生產的含二氧化矽達96%以上的高純度玻璃纖維,具有良好的耐燒蝕性能。模壓成型用高矽氧纖維多用80/5和66/7有捻粗紗。要求不高的場合,也...
微孔玻璃是一種粒狀多孔玻璃,剛性好,機械強度高,主要用於生產高矽氧玻璃,套用於生物工程,遺傳工程、生物和藥品的精製及固化酶。...
後者包括物理成形(研磨和拋光等)和化學成形(高矽氧的微孔玻璃等)。玻璃的成形通常指熱成形。 [1] 中文名 玻璃成形 外文名 glass forming 定義 轉變幾何形狀...
維柯玻璃為一種含硼高矽氧玻璃,是一種耐火石英玻璃。...... 在燒結中特別應注意之點是多孔高矽氧玻璃的比表面積大(可達80-300米2/克),因此表面會吸附大量的...
設計出我國第一座生產甲級料藥用玻璃電熔窯;設計了生產高矽氧玻璃球的電熔窯,使高矽氧玻璃從軍工行業走向民用行業成為可能。設計出我國第一座日產12噸鉛玻璃的...
1939年,美國康寧玻璃公司發明硼矽酸鹽玻璃熱處理分相、酸浸濾然後燒結新工藝,製造出含SiO296%的高矽氧玻璃。低膨脹硼矽酸鹽玻璃全面性能好,尤其抗溫度急變性好,...
設計出我國第一座生產甲級料藥用玻璃電熔窯;設計了生產高矽氧玻璃球的電熔窯,使高矽氧玻璃從軍工行業走向民用行業成為可能。設計出我國第一座日產12噸鉛玻璃的...
本公司主要從事特種玻璃纖維材料系列產品的研發、生產、銷售。其主導產品有:高矽氧纖維繫列連續紗、繩、定長紗、短切紗、高矽氧玻璃纖維布及其製品。中、無鹼系列...
載人飛船、太空梭和人造衛星的風擋和觀察窗採用雙層複合結構,即用耐熱性很高的高矽氧玻璃或石英玻璃作熱屏障層,用熱穩定性好、強度高的化學強化鋁矽酸鹽玻璃作承...
以玻璃纖維、石英纖維及其織物增強的酚醛塑膠主要用於製造各種制動器摩擦片和化工防腐蝕塑膠;高矽氧玻璃纖維和碳纖維增強的酚醛塑膠是航天工業的重要耐燒蝕材料。酚醛...
通華新材料(平湖)有限公司成立於1994年,是一家生產、銷售高矽氧玻璃纖維的股份制企業 ACIT專注於工業超高溫特種纖維的技術及市場研發,主業產品為矽氧特種纖維及製品...
