簡介
晶體結構
冰是無色透明的固體,
分子之間主要靠
氫鍵作用,晶格結構一般為六方體,但因應不同壓力可以有其他晶格結構。密度比水小。
熔點
在常壓環境下,凍的熔點為0℃。0℃水凍結成冰時,體積會增大約1/9(水體積最小時為4℃)。據觀測,封閉條件下水凍結時,體積增加所產生的壓強可達2500
大氣壓。
 冰
冰凍的熔點與壓強存在著一種奇妙的關係:在2200大氣壓以下,凍的熔點隨壓力的增大而降低,大約每升高130個大氣壓降低1攝氏度;超過2200大氣壓後,凍的熔點隨壓力增加而升高:3530大氣壓下凍的熔點為-17℃,6380大氣壓下為 0℃,16500大氣壓下為 60℃,而20670大氣壓下冰在76℃時才熔化,稱為名副其實的“熱冰”。冰在0℃下密度為0.917 g/cm³,而水的密度正常為1.00g/cm³,所以冰會浮於水上。
融化
冰是水在自然界中的固體形態,在常壓環境下,溫度高於零攝氏度時,冰就會開始融化,變為液態水。日本一個研究小組發現,冰開始融化的時候,是以結晶內的一個水分子開始脫離結晶為契機,相關機制有助於弄清含水的蛋白質出現結構變化的機制。
如果用電燈等的強光照射,凍的內部就會融化,浮現出稱為“冰花”的類似雪結晶的形狀。來自日本分子科學研究所和岡山大學的研究人員為了調查冰從內部開始融化的現象,利用計算機演算了由約1000個水分子形成的冰被加熱時將發生什麼變化。
凍的結晶是水分子呈六角形規則排列的結構。加熱之後,首先是一個水分子從結晶脫離,開始自由運動,而這個水分子並不會回到原來的位置,從而導致結晶出現歪曲。而結晶一旦出現歪曲,就會逐漸擴大,最終整個結晶分崩離析,變為液體形態。
特性與功效
特性
水的
熱脹冷縮是反常的,水在低於4度時熱縮冷脹,導緻密度下降,而大於4度時,則恢復熱脹冷縮。這是水最重要也是最奇特的特性之一。
這是保障生物存在的很重要的一點,當水結凍的時候,凍的密度小,浮在水面,可以保障水下生物的生存。當天暖的時候,冰在上面,也是最先解凍。但如果凍的密度比水大,冰會不斷沉到水下,天暖的時候也不會解凍,來年上面的水繼續冰凍,直到所有的水都成了冰,那所有的水生生物都不會存在了。
功效
古書記載
【異名】凌(《綱目》)。
【來源】為水凝成的無色透明的固體。
【功用主治-凍的功效】退熱消暑,解渴除煩。
治傷寒陽毒,熱甚昏迷,中暑煩渴。
①、《本草拾遺》:主去熱煩。
③、《綱目》:傷寒陽毒、熱甚昏迷者,以冰一塊置於膻中,良。
亦解燒酒毒。
【用法與用量】內服:含化.外用:罨敷。
相關知識
特殊的冰
熱冰:除了前面提到高壓下形成的熱冰之外,重水(D2O)在3.8℃時結冰,成為另一種形式的“熱冰”。
水是一種特殊的液體。它在4℃時密度最大。溫度在4℃以上,液態水遵守一般
熱脹冷縮規律。4℃以下,原來水中呈線形分布的縮合
分子中,出現一種像冰晶結構一樣的似冰締合分子,叫做"假冰晶體"。因為凍的密度比水小,“假冰晶體”的存在,降低了水的密度,這就是為什麼水在4℃時密度最大,低於4℃密度又要減小的秘密。
人類已經能夠在實驗室里製造出八種凍的晶體。但只有天然冰能在自然條件下存在,其它都是高壓冰,在自然界不能穩定存在。
天然冰中水分子的締合是按六方晶系的規則排列起來的。所謂結晶格子,最簡單的例子是緊密地堆砌的磚塊,如果在這些磚塊的中心處代之以一個假設的原子,便得到了一個結晶格子。凍的晶格為一個帶頂錐的
三稜柱體,六個角上的
氧原子分別為相鄰六個晶胞所共有。三個棱上氧原子各為三個相鄰
晶胞所共有,二個軸頂氧
原子各為二個晶胞所共有,只有中央一個
氧原子算是該晶胞所獨有。
註:一般被稱為
乾冰的物質實際是二氧化碳的固體狀態,
與水和冰沒有關係。
乾冰是二氧化碳的固體形式。在正常氣壓下,二氧化碳的
凝固點是攝氏負78.5度,在保持物體維持冷凍或低溫狀態下非常有用。它無色,無味,不易燃,略帶酸性。乾冰的密度各不相同,但通常約為 1.4至1.6 g/cm。乾冰能夠急速的冷凍物體和降低溫度並且可以用隔離手套來做配置。到二十一世紀,乾冰已經被廣泛的使用在許多層面了,乾冰在增溫時是由固態直接升華為氣態,直接轉化為氣體而省略轉為液態的程式,因此其相變並不會產生液體,也因此我們稱它做“乾冰”。要將二氧化碳變成液態,就必須加大壓強至5.1
大氣壓才會出現液態二氧化碳。
冰與水
由於水分子間有
氫鍵締合這樣的特殊結構所決定的。根據近代
X射線的研究,證明了冰具有四面體的晶體結構。這個四面體是通過氫鍵形成的,是一個敞開式的鬆弛結構,因為五個水分子不能把全部四面體的體積占完,在冰中氫鍵把這些四面體聯繫起來,成為一個整體。這種通過氫鍵形成的定向有序排列,空間利用率較小,約占34%、因此凍的密度較小,約為攝氏4度時液態水的9/10。
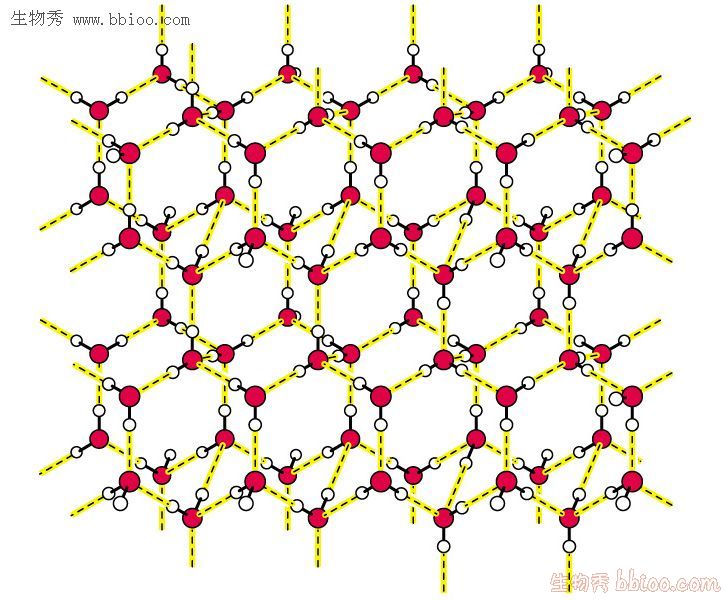 凍的分子模型
凍的分子模型冰融化時拆散了大量的氫鍵,使整體化為四面體集團和零星的較小的“水分子集團”(即由氫鍵締合形成的一些締合分子),故液態水已經不象冰那樣完全是有序排列了,而是有一定程度的無序排列,即水分子間的距離不象冰中那樣固定,H2O分子可以由一個四面體的微晶進入另一微晶中去。這樣分子間的空隙減少,密度相對冰就增大了。
溫度升高時,水分子的四面體集團不斷被破壞,分子無序排列增多,使密度增大。但同時,分子間的熱運動也增加了分子間的距離,使密度又減小。這兩個矛盾的因素在4℃時達到平衡,因此,在4℃時水的密度最大。過了4℃後,分子的熱運動使分子間的距離增大的因素,就占優勢了,水的密度又開始減小。
河冰
黃河流域是中華民族的
搖籃,孕育了華夏五千年的文明。但是黃河帶給我們中華民族的不全是好處,黃河洪水和冰害經常掠去兩岸人民的財產和生命。
 結冰
結冰遠在公元前四百多年,對於黃河的冰情,已有詳細的記載:“
孟冬之月,水始冰,地始凍。
仲冬之月,冰益堅,地始坼。
季冬之月,凍方盛,
水澤腹堅,命取冰,冰以入。
孟春之月,東風解凍,蟄蟲始振,
魚上冰。”這是世界上最早的有關結冰、封凍和解凍的冰情文字記錄。
陸地冰
全球陸地表面上的凍的體積,總共有26,660,000立方千米,相當於24,000,000立方千米的水。其中絕大部分的冰都集中在南極地帶——23,820,000立方千米。假使這些冰化成水,相當於全世界的河流的六百五十年的流量,它們足以使全世界的海洋的水位升高六十六點三米。
相關成語
冰雪聰穎、
如履薄冰、冰天雪地、
玉潔冰清、瓦解冰銷(
瓦解冰泮)、夏蟲不可以語冰、
冰消雪釋、冰壺秋月、冰雪消融、冰心雪操、冰封雪飄、冰魂雪魄、冰封雪蓋、
冰解凍釋、冰雪封路、冰弦玉柱、冰清瓦解、前嫌冰釋、一片冰心、冷若冰霜、滴水成冰、如履薄冰、冰比水冷、冰寒於水、
冰魂素魄、冰肌玉骨、
冰潔淵清、冰解的破、冰解凍釋、冰解壤分、冰清水冷、冰清玉粹、冰清玉潤、冰散冰清水冷、冰清玉粹、
冰清玉潤、冰散瓦解、冰炭不同爐、冰炭不同器、
冰天雪窖、冰消凍解、
冰銷葉散、冰雪聰明。
 冰
冰 凍的分子模型
凍的分子模型 結冰
結冰
