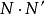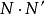電泳基本原理,電泳的分類,無支持物的電泳技術,有支持體的電泳技術,電泳遷移率及影響因素,電泳遷移率,影響電泳的主要因素,常用電泳儀器,手工電泳裝置,全自動電泳分析儀,區帶電泳,區帶電泳基本原理,區帶電泳介質的選擇,實例分析,
電泳基本原理
帶電粒子在電場的作用下,向著與其電性相反的電極移動的現象,稱為電泳。利用帶電粒子在電場中移動速度不同,對混合物各組份進行分離、純化和測定的技術稱為電泳技術。可分離的樣品即可以是大分子的蛋白質、多糖、核酸,也可以是小分子的胺基酸,核苷等。電泳方式差別很大.但基本原理是一致的,即:待分離樣品中各種分子在同一pH下帶電性質和帶電量以及分子本身大小、形狀等性質的差異,使帶電分子在電場中產生不同的遷移速度,從而實現對樣品分離、鑑定或提純。
電泳的分類
不同種類的電泳實現方式和技術關鍵各不相同,紛繁複雜:目前,尚沒有任何一種分類體系可以做到不重複的涵蓋所有電泳方式。綜合考慮支持物類型、電泳原理、用途等因素的系統分類方法簡單清晰,而且主要的電泳種類都能在該體系中找到自己的位置。
按是否使用支持物分為:
無支持物的電泳技術
此類電泳也稱自由電泳。電泳方式是直接將待測樣品溶於適當的緩衝液中,在緩衝液兩端通電,形成電場,帶點粒子在溶液中自由式動達到分離的效果。包括Tise-leas式微量電泳、顯微電泳、等電聚焦電泳、等速電泳及密度梯度電泳等。自由電泳由於電泳儀構造複雜、體積龐大,操作要求嚴格,價格昂貴等原因,發展比較緩慢。往往只有當其他技術難以滿足分析、分離要求時才會選擇自由電泳,如等電聚焦電泳是準確測量蛋白質等電點的無可替代的方法。
有支持體的電泳技術
電泳方式是選擇濾紙、凝膠等適當物質做支持物,將支持物兩端或全部浸入緩衝液中,並達到緩衝體系平衡,在支持物上加樣,緩衝液兩端加電壓,形成電場從而實現電泳效果。帶點粒子本身性質和支持物口徑大小等因素共同決定其泳動的最終位置。電泳結果表現為不同組份形成相隔離的區帶,故此類電泳又稱區帶電泳,包括紙電泳,醋酸纖維薄膜電泳,薄層電泳,粉末電泳(支持物有:澱粉,纖維素粉,玻璃粉等),凝膠電泳(聚丙烯醯凝膠,矽膠,瓊脂(糖)凝膠)。區帶電泳種類繁多,套用十分廣泛,發展迅速是生物分析技術中的熱點之一。
區帶電泳根據支持物裝置和電泳方向不同分為
(1)平板式電泳:裝置為玻璃板,水平方向電泳。
(2)垂直柱式電泳:裝置為玻璃管,垂直方向電泳。
(3)垂直板式電泳:裝置為玻璃板,垂直方向電泳。
(4)毛細管區帶電泳:以毛細管為分離通道。
電泳遷移率及影響因素
電泳遷移率
帶電粒子在電泳過程中得以分離,依賴於不同粒子在同一電場強度下泳動的速度不同。帶電粒子在電場中的移動速度,用遷移率(或稱泳動度,mobility,μ)表示。遷移率的定義為帶電粒子在單位電場強度下的泳動速度。
式1中
為遷移率;v為帶電粒子移動速度;E為電場強度。
帶電粒子在電場中的泳動速度,由一對相反的作用力一電場力和阻力決定。其中
式2中F——電場力(牛頓);q——離子的淨電荷(庫侖);E——電場強度(伏特/米):式3中
——阻力(牛頓);r——粒子半徑(米);
——介質粘度(牛頓·秒/米
2)。
當這兩個力相等時,泳動速度恆定,與F成正比,與
成反比。即
由式5可見:帶電顆粒在電場中泳動的速度與電場強度和帶電顆粒子的淨電荷量成正比,而與顆粒半徑和介質黏度成反比。
影響電泳的主要因素
帶電粒子遷移率不同是電泳分離的基礎,因此影響遷移率的所有因素都是影響電泳的因素。由式5可見,這些因素即包括帶電粒子本身的性質,也包括電泳體系的條件,甚至不同類型的電泳主要影響因素也不相同。下面簡單討論一下這些條件。
1.帶電粒子性質
帶電粒子所帶的靜電荷量、粒子大小、形狀等性質對泳動速度有明顯影響。一般情況下,粒子所帶淨電荷量越大,直徑越小,形狀越接近球形,其在電場中的泳動速度就越快:反之,則越慢。
2.電場強度
電場強度是每厘米的電位降,也稱電位梯度。由式1可見,電場強度越大,電泳速度越快。反之,則越慢。根據電場強度大小,電泳可分為常壓電泳和高壓電泳。前者電場強度為2~10V/cm,後者為20~00V/cm。用高壓電泳分離樣品比常壓電泳用時短。應該指出,並不是電場強度越大越有利於電泳分離。電場強度的增大,通過介質的電流強度隨之增大,將造成電泳過程產生的熱量增大,進而影響電泳效果。
3.緩衝體系性質
(1)PH值
緩衝液的pH值決定帶電粒子的解離程度,及其帶淨電荷的量。電泳速度因此受很大影響。對兩性分子而言,pH值還決定帶電粒子的電性,進而影響其電泳方向。一般說來,緩衝液pH值離兩性分子等電點愈遠,其帶淨電荷量愈大,泳動速度就愈快。反之,則愈慢。
(2)離子強度
緩衝液的離子強度通常保持在0.02~0.2之間較合適。離子強度過低,則體系緩衝能力差,往往會因電泳過程中溶液pH值變化而影響泳動速度的穩定性。離子強度過高,則會因靜電引力作用降低顆粒的泳動速度。
(3)黏度
由式5可見,緩衝體系液黏度與遷移率成反比。因此,溶液黏度越大電泳速度越小,反之,越大。
4.電滲
電滲指在電場中液體對固體支持物的相對移動,如濾紙表面帶負電,帶正電的水層便會向負極移動。當支持物不是絕對惰性物質時,電滲現象與電泳同時存在。電滲與電泳方向一致時,就會產生類似順風游泳的情況,加快電泳速度;反之,則降低顆粒的泳動速度。(圖1)
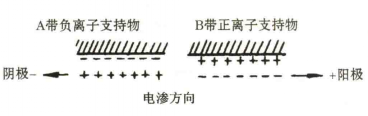 圖1 電滲示意圖
圖1 電滲示意圖5.焦耳熱
電泳過程中釋放出的熱量與電流的平方成正比。當電場強度增大或電極緩衝液中離子強度增高時,電流會隨著增大。如果散熱系統無法滿足需要,電泳體系溫度就會有較大升高。這不僅降低解析度,而且在嚴重時會燒斷濾紙或熔化瓊脂糖凝膠支持物。
6.支持介質的篩孔大小
支持介質的篩孔大小取決於支持介質性質和濃度。實驗時需根據電泳分析、分離的目的慎重選擇篩孔的大小。篩孔大的介質中,電泳速度快,解析度較低。反之,則泳動速度慢,解析度較高。
常用電泳儀器
手工電泳裝置
1.電泳槽
電泳槽是電泳系統的核心部分。一般由裝有鉑金絲電極的主槽和膠室支架組成。主槽中注入緩衝液,並連線電源的正、負極;膠室支架放電泳支持物,與主槽電極緩衝液接觸或直接浸沒入緩衝液中。根據實驗設計可分為管式電泳槽、垂直板電泳槽、水平板電泳槽等類型。
 圖2垂直板式電泳槽
圖2垂直板式電泳槽 圖3平板式電泳槽
圖3平板式電泳槽2.電 源
電源的作用是建立電泳電場。而電場與電壓有關,一般可分為:常壓電泳:100~500V,場強1~10V/cm,分離時間較長;高壓電泳:500~10kV,場強20~200V/cm,分離時間短。也可根據功率輸出特點將電源分為穩流、穩壓和穩功率三種類型。
3.外循環恆溫系統
高電壓會產生高熱,需冷卻。常壓電泳一般只要將電泳槽上配備的冷凝水上管接通自來水,下管接實驗室水槽即可。高壓或分離條件較苛刻的電泳則需配備專門的外循環恆溫系統。
4.電泳區帶分析裝置
電泳分離後將電泳區帶切下,再用洗脫液洗脫下來,可用分光光度計測定每一區帶組分濃度。也可用凝膠成像分析系統直接對電泳區帶進行密度掃描,從而得出相對百分比,並可繪製出曲線圖,計算出相對面積。
全自動電泳分析儀
從電泳技術問世起,效果最最佳化和操作簡便化就是科研工作者的不懈追求。隨著電泳技術的發展和進步,各種先進電泳儀的不斷湧現:1990年以來Pharmacia LKB公司、法國Sebia、美國Helena等紛紛推出全自動電泳系統。下面以Helena公司的SPIFE3000全自動血漿蛋白質、血清免疫固定電泳(IFE)、鹼性磷酸酶、尿蛋白、膽固醇、乳酸脫氫酶等:系統由計算機、掃瞄器、印表機和主機組成。操作者根據需要,預先將樣品數量、凝膠性質、電泳時間等參數編入程式,系統可自動完成點樣、電泳、傾倒和塗抹試劑、染色、固定、脫色和乾燥等操作,並可自動掃描,完成結果分析和輸出。
 圖4 SPIFE3000全自動電泳儀
圖4 SPIFE3000全自動電泳儀區帶電泳
區帶電泳(zone electrophoresis)是有支持介質的電泳,樣品中各組份在支持介質上分離成若干區帶,是一種在生物測試領域中套用最廣泛的電泳方法。區帶電泳因所用支持介質的種類和電泳方式等不同,在科研實踐中的套用價值也各有差異,電泳條件和介質的選擇是電泳成敗的關鍵。
區帶電泳基本原理
區帶電泳常用來分離分析DNA、蛋白質等生物大分子。選擇適當的在pH值,使pH>pl,則待分離組分帶負電將向正極移動。其遷移率是電場作用、待測組分性質、固相介質吸附作用等各種影響因素綜合的結果。電泳後,將吸附了待測組分的介質浸於適當染料中使之結合,經乾燥處理,光密度計掃描,以各峰面積積分結果計算各組分含量。
區帶電泳介質的選擇
區帶電泳是依靠帶電粒子在電泳介質上泳動而實現分離的手段。電泳介質的選擇極大的影響著電泳的結果。在選擇凝膠介質時,一般需從影響電泳遷移率的諸因素、技術可行性、資源最最佳化、待測組分性質等方面綜合考慮。常用介質包括以下幾種:
(一)濾紙
區帶電泳發展之初,以濕潤的濾紙作為電泳介質。隨後,紙層析技術出現,電泳和層析技術的結合極大的擴展了濾紙電泳的套用範圍。紙電泳具有設備簡單、操作方便的優點。同時也存在著電滲現象嚴重,操作時間長、解析度較差等劣勢。目前,已逐步被許多新型材料取代。
(二)醋酸纖維素膜
醋酸纖維素是由纖維素的羥基經乙醯化而成纖維素醋酸酯。醋酸纖維素膜對蛋白質樣品的吸附作用極小,有利於避免“拖尾”現象,是蛋白質電泳的常用介質之一。醋酸纖維素膜吸水性小,有利於節約緩衝液,加快電泳速度。醋酸纖維素膜的電泳圖譜經透明液處理後可使膜質透明化,有利於測定和長期保存。其缺點在於有電滲作用。
(三)瓊脂糖凝膠
瓊脂糖主要成分是一種直鏈多糖,微波或水浴中加熱可溶解與水中,冷卻後依靠糖鏈之間的次級鏈如氫鍵來維持網狀結構,網狀結構的疏密與瓊脂糖的濃度相關。瓊脂糖親水性強,且不含帶電荷的基團,極大減少了待測樣品變性和吸附。目前,主要用於核酸分析。
(四)聚丙烯醯胺
聚丙烯醯胺是丙烯醯胺單體和甲叉雙丙烯醯胺交聯劑按一定比例混合,在催化劑(如過硫酸銨)作用下聚合而成的交叉網狀結構的凝膠,使其產生分子篩效應。凝膠孔徑大小可以通過製備時所使用的濃度和交聯度控制。聚丙烯醯胺凝膠的優點是兼有電泳介質及分子篩的功能,大大提高了分離能力,是目前分辨能力最高的電泳介質。
實例分析
菌體蛋白質電泳
目前,疫黴菌的分類鑑定仍以形態特徵為主要依據。但是,由於疫黴菌形態變異較大,一些分類依據不穩定,因而有時依據形態難以鑑定。已經證明,同種疫毒菌菌株間的菌體可溶性蛋白質電泳圖譜相似,主要蛋白帶型相同。套用這一技術,已成功地確定了一些依據形態特徵難以鑑定的疫黴菌株的分類地位。
一、蛋白質樣品的製備
將新鮮培養的菌絲塊(大小約2×2mm)數塊接種於盛有適合疫黴菌生長的培養液的平底燒瓶中(每個250ml容量的平底燒瓶裝150ml培養液)。在適溫、黑暗條件下靜置培養7天左右,用乾淨紗布濾出菌絲體。將菌絲叢中的培養基小塊去掉,菌絲體用25%乙醇沖洗,再用蒸餾水反覆沖洗3~4 次,在雙層紗布中擠去多餘的水份。收集沖洗後的菌絲並稱濕重,按1:1(W/V) 加入pH6的磷酸緩衝液(0.2M Na2HPO4 123ml與0.2M NaH2PO4877ml 混合配製),冰凍過夜。將冰凍後的菌絲體置於研砵中,加入少量石英砂,在冰浴下充分研磨成糊狀。研磨後的菌絲液在18000轉/分、4℃下離心1小時,傾出上清液。在上清液中加入10~15%的甘油或蔗糖(以防止加樣後樣品在電極緩衝液中漂浮),即為菌體可溶性蛋白質電泳樣品。
確定電泳樣品中蛋白質含量:將標準酪蛋白溶解在pH6的磷酸緩衝液中,配成系列濃度。用紫外分光光度計在280nm波長下測定各濃度的OD值,畫出標準曲線。在相同光波長下測定電泳樣品的OD值,根據該OD值從標準曲線上查找出電泳樣品的蛋白質含量。
二、聚丙烯醯胺凝膠垂直平板電泳
(一) 電泳貯備液
1號液::1N HCI 48ml,三羥甲基氨基甲烷(Tris)36.6g,四甲基乙二胺(TEMED)0.5ml,用蒸餾水定容至100ml,pH8.9。
2號液:1N HCl 48ml,三羥甲基氨基甲烷5.98g,四甲基乙二胺0.7ml,用蒸餾水定容至100ml,pH6.7。
3號液:丙烯醯胺28.0g,
亞甲基雙丙烯醯胺0.735g,用蒸餾水定容至100ml。
4 號液:丙烯醯胺10.0g,
亞甲基雙丙烯醯胺0.25g,用蒸餾水定容至100ml。
5 號液:過硫酸銨0.14g,用蒸餾水定容至100ml。
上述1、2、3和4號液配製後盛於棕色瓶中於4℃下保存,可貯藏1~2個月,但5號液配製後冷藏時間不超過1星期。
電極緩衝液:三羥甲基氨基甲烷6.0g,甘氨酸28.8g,用蒸餾水定容至1000ml。使用前稀釋10倍。
(二) 制膠
取1號、3號液、蒸餾水和5號液按2:4:8:8的比例混合,加入垂直電泳槽製成分離膠。待分離膠凝固後,取2 號、4號液、蒸餾水和5號液按1:2:1:4比例混合,在電泳槽上插入加樣梳,灌入依縮膠。待濃縮膠凝固後,拔出加樣梳,並吸去加樣孔中多餘的水分。
(三)電泳
用微量加樣器在各加桿孔中加入電泳樣品,每孔的蛋白質加樣量為100μg左右。在電泳槽中加入電極緩衝液並滴加2滴1%溴酚蘭指示前沿線,電泳。開始時電流強度用30mA,待樣本進入分離膠時調至50mA。電泳過程中,將電泳槽置4℃冰櫃中進行。
三、染色與脫色
電泳結束後,將凝膠薄片取下,置於考馬斯亮蘭R250染色液(考馬斯亮蘭R250 2.5g,三氯醋酸200ml,加水至1000ml)中染色24小時。傾去染色液,用7%醋酸溶液脫色至膠片背景近於無色。膠片可供拍照、繪圖和結果分析用。
四、電泳圖譜繪製與分析
根據聚丙烯醯胺凝膠薄片上蛋白質電泳帶的粗細、深淺和遷移率,繪製電泳圖譜,並計算相似率。
(一)遷移率計算
遷移率=(起點至蛋白帶的距離/起點至指示劑前沿線的距離)×100%.
其中起點系指加樣一端分離膠的起點線,指示劑前沿線指電泳結束時溴酚蘭指示劑在膠板另一端形成的藍色線。例如,某蛋白帶的遷移距離是3cm,起點至指示劑前沿線距離是10cm,則該蛋白帶的遷移率為0.3。比較兩個菌株間的相似性時,遷移率差異小於0.03的兩條蛋白帶被視為相似的蛋白帶。
(二)菌株間的相似率計算
相似率=(兩菌株相似蛋白帶的數目/兩菌株蛋白帶的總數)×100%.
例如,兩個菌株間遷移率相似的蛋白帶有5對(10條),兩菌株蛋白帶總數為15條,則這兩個菌株的相似率為67。相似率越高,菌株間的相似性越大。通常,同一個疫霉種菌株間的可溶性菌體蛋白質電泳圖譜相似率在75~100之間。
為了提高蛋白質電泳結果的準確性,每一塊膠板應同時用已知標準菌株與供試菌株一起電泳作為對照。

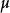

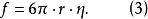
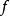
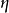
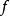

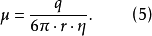
 圖1 電滲示意圖
圖1 電滲示意圖 圖2垂直板式電泳槽
圖2垂直板式電泳槽 圖3平板式電泳槽
圖3平板式電泳槽 圖4 SPIFE3000全自動電泳儀
圖4 SPIFE3000全自動電泳儀