基本介紹
- 中文名:電化學發電
- 外文名:Electrochemical power generation
- 主要套用於:化學電源、生命現象研究
- 主要產品:化學電池
- 最早始於:1663年
- 典型代表:原電池、燃料電池
發展
原電池
組成原電池的基本條件
原電池工作原理
原電池的電極的判斷
原電池的判定
原電池原理的腐蝕
 與化學腐蝕的比較
與化學腐蝕的比較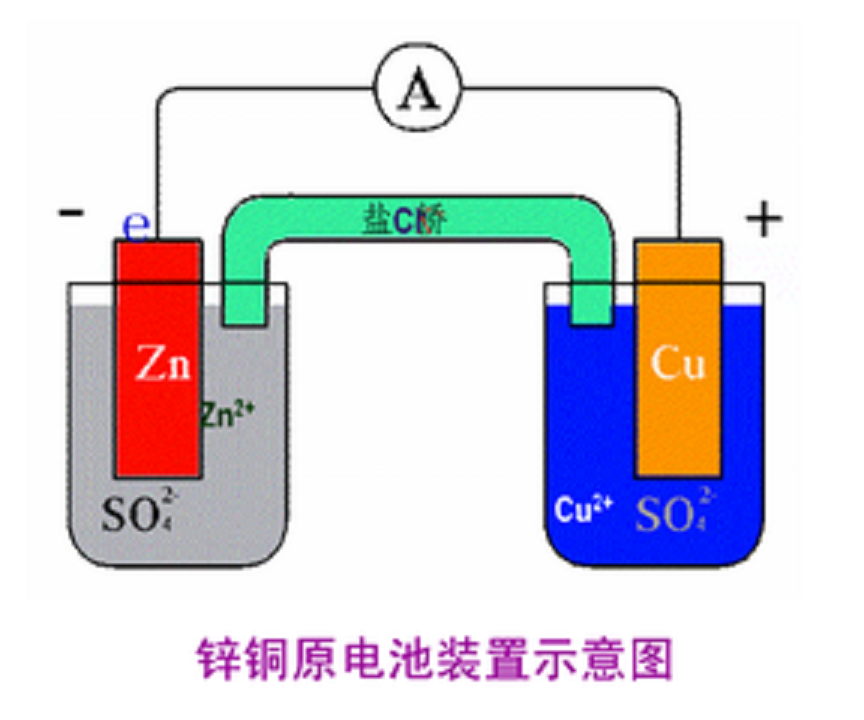
 與化學腐蝕的比較
與化學腐蝕的比較電化學發電主要指利用電化學原理實現化學反應中的化學能轉化為電能。例如:燃料電池是將燃料的化學能通過化學反應轉化為電能的裝置。目前國際上一些科研機構和財團已經...
電化學是研究兩類導體形成的帶電界面現象及其上所發生的變化的科學。電和化學反應相互作用可通過電池來完成,也可利用高壓靜電放電來實現(如氧通過無聲放電管轉變為...
為了調節峰荷、電網中常需要啟動快和比較靈活的發電站,氫能發電就最適合搶演這個角色。更新的氫能發電方式是氫燃料電池。這是利用氫和氧(成空氣)直接經過電化學...
《綠色電化學合成》是2016年化學工業出版社出版的一本書籍,書籍的作者是馬淳安 等。...
微型發電是一種小規模的發電模式,電能由個人、小企業或社區自行生產,以滿足自身需求,目的是輔助甚至取代集中式電網,減少電網穩定性問題,避免長途輸電,降低電力成本,...
光伏發電是利用太陽能級半導體電子器件有效地吸收太陽光輻射能,並使之轉變成電能的直接發電方式,是當今太陽光發電的主流。在光化學發電中有電化學光伏電池、光電解...
電流體發電機指的是將機械能轉變成電能的發電機。廣泛套用於生活與工業生產。...... 耐鹼腐蝕、耐化學燒蝕等,目前所用材料的壽命都比較短,因而電流體發電機不能長...
生物質氣化燃料電池發電是利用高溫燃料電池技術(MCFC 、SOFC), 直接將生物質氣的化學能轉化為電能, 不受卡諾循環限制, 而且具有潔淨、噪聲低、可靠性高等特點。...
燃料電池工作時,不需要燃燒,同時不污染環境,其電能是通過電化學過程獲得的。在...(3)混合的分散式發電技術通常是指兩種或多種分散式發電技術及蓄能裝置組合起來,...
生物電化學可以定義為一門套用電化學及實驗方法研究生物現象的邊緣分支學科。...... 生物電化學可以定義為一門套用電化學及...單位,它們還是一台台的“微型發電機”...
“細菌電池”,的原料是地下的細菌,細菌在吞噬糖的過程中,能夠把能量轉化為電。...直到20世紀80年代末,細菌發電才有了重大突破,英國化學家彼得·彭托在細菌發電...
“我們努力的目標是用生物燃料實現高效率發電,”他說,“利用我們現在研發的設備,能夠從尿液或者廢水中得到氨,然後設法實現高效的電化學反應來獲得能源。”...
1939年9月生,河南省西峽縣人,漢族,研究員。1964年畢業於天津大學電化學專業。相繼在中科院力學所、航天部五院501部工作。1978年調入北京太陽能所, 先後任研究室...
新能源互補發電系統主要由風力發電機組和太陽能發電機組構成,由控制器、逆變器、...其中蓄電池組是電化學儲能中的一種存儲電能設備,在國內套用最多,技術較為成熟,...
電力燃料電池是指一種把燃料所具有的化學能直接轉換成電能的化學裝置,又稱電化學發電器。...
氫燃料電池是將氫氣和氧氣的化學能直接轉換成電能的發電裝置。其基本原理是電解水的逆反應,把氫和氧分別供給陽極和陰極,氫通過陽極向外擴散和電解質發生反應後,放...
燃料電池是一種把燃料所具有的化學能直接轉換成電能的化學裝置,又稱電化學發電器。它是繼水力發電、熱能發電和原子能發電之後的第四種發電技術。由於燃料電池是通過...
