概念介紹,一般用途,歷史,衡量方法,測量,電量分析,電子質量測量,晶體密度法,國際組織,科學成就,數值測定,概述,計算公式,常數定律,測定原理,測量歷史,其它常量關係,阿伏伽德羅,
概念介紹 在物理學和化學中,
阿伏伽德羅常數 (符號:
N A 或
L )的定義是一個比值,是一個樣本中所含的基本單元數(一般為
原子 或
分子 )
N ,與它所含的
物質的量 n (單位為
摩爾 )間的比值,公式為
N A =
N /
n 。因此,它是聯繫一種粒子的
摩爾質量 (即1摩爾時的質量),及其質量間的比例常數。阿伏伽德羅常數用於代表1摩爾物質所含的基本單元(如分子或原子)之數量,而它的數值為:
在一般計算時,常取6.02×10 23 6.022×1023 為近似值。
較早的定義中所訂的另一個數值為
阿伏伽德羅數 ,歷史上這個詞與阿伏伽德羅常量有著密切的關係。當
國際單位制 (SI)修訂了基本單位後,所有化學數量的概念都必需被重定義。阿伏伽德羅數的新定義由
讓·佩蘭 所下,定為2克分子氫所含的分子數。跟它一樣的是,12克同位素碳-12所含的原子數量。因此,阿伏伽德羅數是一個無
量綱 的數量,與用基本單位表示的阿伏伽德羅常量數值一致。科學家還在不斷精確化阿伏加德羅常數,最新的研究論文發現其數值為
6.02214082(11)×1023 ,括弧中的數字表示最後兩位估值數字的不確定性。
阿伏伽德羅常數 的定義值是指0.012千克
1 2 C所含的
原子數 ,6.02×10
2 3 。這個數值是阿伏加德羅常數的近似值,兩者是有區別的。阿伏加德羅常數的符號為
N A ,不是
純數 。其單位為/mol。
阿伏伽德羅 常數可用多種實驗方法測得,到目前為止測得比較精確的數據是6.0221367×10
2 3 mol
- 1 ,這個數值還會隨測定技術的發展而改變。把每摩爾物質含有的微粒數定為阿伏加德羅常數,而不是說含有6.02×10
2 3 個微粒。在定義中引用實驗測得的數據是不妥當的,不要在概念中簡單地以6.02×10
2 3 來代替“阿伏加德羅常數”。
2018年11月16日,國際計量大會通過決議,1摩爾將定義為“精確包含6.02214076×10^23個原子或分子等基本單元的系統的物質的量”。與此同時修改了阿伏伽德羅常數為6.02214076×10^23。
一般用途 阿伏伽德羅常數是一個
比例因子 ,聯繫自然中巨觀與微觀(原子尺度)的觀測。它本身就為其他常數及性質提供了關係式。例如,它確立了
氣體常數 R 與玻耳茲曼常數
k B 間的關係式,
歷史 阿伏伽德羅常數因
阿莫迪歐·阿伏伽德羅 而得名,他是一名19世紀早期的義大利化學家,在1811年他率先提出,氣體的體積(在某溫度與壓力下)與所含的分子或原子數量成正比,與該氣體的性質無關。法國物理學家
讓·佩蘭 於1909年提出,把常數命名為阿伏伽德羅常量來紀念他。佩蘭於1926年獲頒
諾貝爾物理學獎 ,他研究一大課題就是各種量度阿伏伽德羅常量的方法。
阿伏伽德羅常量的值,最早由奧地利化學及物理學家約翰·約瑟夫·洛施米特(Johann Josef Loschmidt)於1865年所得,他透過計算某固定體積氣體內所含的分子數,成功估計出空氣中分子的平均直徑。前者的數值,即
理想氣體 的數量密度,叫“洛施米特常數”,就是以他命名的,這個常數大約與阿伏伽德羅常量成正比。由於阿伏伽德羅常量有時會用
L 表示,所以不要與洛施米特(Loschmidt)的
L 混淆,而在德語文獻中可能時會把它們都叫作“洛施米特常數”,只能用
計量單位 來分辨提及的到底是哪一個。
要準確地量度出阿伏伽德羅常量的值,需要在巨觀和微觀尺度下,用同一個單位,去量度同一個物理量。這樣做在早年並不可行,直到1910年,羅伯特·密立根成功量度到一個電子的電荷,才能夠藉助單個電子的電荷來做到微觀量度。一摩爾電子的電荷是一個常數,叫法拉第常數,在麥可·法拉第於1834年發表的電解研究中有提及過。把一摩爾電子的電荷,除以單個電子的電荷,可得阿伏伽德羅常量 。自1910年以來,新的計算能更準確地確定,法拉第常數及基本電荷的值(見下文#測量)。
讓·佩蘭 最早提出阿伏伽德羅數(
N )這樣一個名字,來代表一克分子的氫(根據當時的定義,即32克整的氧),而這個詞至今仍被廣泛使用,尤其是入門課本改用阿伏伽德羅常量(
N A )這個名字,是1971年摩爾成為
國際單位制基本單位 後的事,因為自此物質的量就被認定是一個獨立的
量綱 。於是,阿伏伽德羅數再也不是純數,因為帶一個
計量單位 :摩爾的倒數(mol
-1 )。
儘管不用摩爾來量度物質的量是挺罕見的,但是阿伏伽德羅常量可用其他單位表示,如磅摩爾(lb-mol)或盎司摩爾(oz-mol)。
衡量方法 阿伏加德羅常數是有
量綱 的,就是那么一堆東西,那么多
粒子 就叫1mol。摩爾就是“一堆”古希臘叫做“堆量”。那么一堆數量就叫一
摩爾 ,它是
物質的量 的單位,說白了就是粒子“堆”數的單位。
相對分子質量 的單位是1,當
摩爾質量 以克每摩爾為單位時,兩者數值上相等。
阿伏伽德羅常數 資料一
摩爾是表示物質的量的單位,每摩爾物質含有阿伏加德羅常數個微粒。摩爾是
國際單位制 中的
基本單位 之一,用於表示物質的量,簡稱摩,符號為
mol 。1971年第十四屆
國際計量大會 規定:“摩爾是一系統的物質的量,該系統中所包含的
基本單元 數與0.012kg
1 2 C的原子數目相等。使用摩爾時應予以指明基本單元,它可以是原子、分子、離子、電子及其他粒子,或是這些粒子的特定組合。”摩爾好似一座橋樑把單個的、肉眼看不見的微粒跟大數量的微粒集體、可稱量的物質之間聯繫起來了。在
化學計算 中套用摩爾十分方便。
資料二
阿伏加德羅 常數,0.012kg
1 2 C中所含的原子數目叫做阿伏加德羅常數。阿伏加德羅常數的符號為
N A 。阿伏加德羅常數的近似值為:6.02×10
2 3 /mol。
符號:N A
含義:1mol任何粒子所含的粒子數均為阿伏加德羅常數
測量 電量分析 最早能準確地測量出阿伏伽德羅常量的方法,是基於
電量分析 (又稱庫侖法)理論。原理是測量
法拉第常數 F ,即一摩爾電子所帶的電荷,然後將它除以
基本電荷 e ,可得阿伏伽德羅常量。N
A =F/e
國家標準技術研究所(NIST)的鮑瓦爾與戴維斯(Bower & Davis)實驗在這一方法中堪稱經典 ,原實驗中
電解 槽的
陽極 是銀制的,通電後銀會“溶解”,實驗中電量計所量度的就是這些
單價 銀離子所帶的電量,電解液為
過氯酸 ,內含小量
過氯酸銀 。設電流的大小為
I ,通電時間為
t ,從陽極中離開的銀原子質量為
m 及銀的原子重量為
A r ,則法拉第常數為:
原實驗中部份銀原子會因機械性摩擦而脫落,而非通過電解,所以想通過銀電極的消耗量來獲得因電解而消耗的銀原子質量
m ,就必須要解決摩擦造成的質量消耗問題,同時又不能大幅增加實驗誤差,為此NIST的科學家們設計出一種能補償這個質量的方法:他們改在電解質中添加已知質量
m 的銀離子,並使用
鉑 制的
陰極 ,銀離子會在陰極上形成鍍層,通過觀測鍍層來得知實驗進程。法拉第常數的慣用值為
F 90 = 96,485.39(13) C/mol,對應的阿伏伽德羅常量值為 6.022 144 9(78)×10
2 3 /mol:兩個數值的相對標準不確定度皆小於1.3×10
- 6 。
電子質量測量 科學技術數據委員會(CODATA)負責發表國際用的物理常數數值。它在計量阿伏伽德羅常量時,用到電子的摩爾質量A r (e)M u ,與電子質量m e 間的比值:
電子的
相對原子質量 A r (e),是一種可直接測量的量,而摩爾質量常數
M u ,在
國際單位制 中其大小是有定義的,不用測量。然而,要得出電子的
靜止質量 ,必須通過計算,其中要使用其他需要測量的常數:
由下表2010年國際科學技術數據委員會(CODATA)的值,可見限制阿伏伽德羅常量精確度的主要因素,是
普朗克常數 ,因為計算用的其他常數都相對地準確。
常數 符號 2014年的數值 相對標準的不確定度 與N A 的 電子的相對原子質量
A r (e)
5.485 799 09070(16)×10-4 u
2.9×10-11
0.0011
摩爾質量常數
M u
0.001 kg/mol=1g/mol
定義
—
里德伯常數
R ∞
10 973 731.568 508(65) m-1
5.9×10-12
-0.0002
h
6.626 070 040(81)×10-34 Js
1.2×10-8
-0.9993
c
299 792 458 m/s
定義
—
α
7.297 352 5664(17)×10-3
2.3×10-10
0.0193
阿伏伽德羅常量
N A
6.022 140 857(74)×1023 mol-1
1.2×10-8
1
晶體密度法 運用
X射線晶體學 ,是一種能得出阿伏伽德羅常量的現代方法。現今的商業設備可以生產出單晶矽,產物有著極高的純度,及極少晶格缺陷。這種方法把阿伏伽德羅常量定為一個比值,
摩爾體積 V m 與原子體積
V atom 間的比值:
其中
,而
n 則為每一體積為體積
V cell 的
晶胞 內所含的原子數。
矽的晶胞有著由8個原子組成立方式充填排列,因此晶胞單元的體積,可由測量一個晶胞參數得出,而這個參數a 就是立方的邊長。
實際上,所測量的距離叫
d 220 (Si),即
密勒指數 {220}所述的各平面間的距離,相等於
。2010年CODATA的
d 220 (Si)數值為192.015 571 4(32)pm,相對不確定度為1.6×10
- 8 ,對應的晶胞體積為1.601 933 29(7 7)×10
- 2 8 m。
有必要測量樣本的
同位素 成份比例,並在計算時考慮在內。矽共有三種穩定的同位素(
28 Si,
29 Si,,
30 Si),它們在自然界的比例差異,比其他測量常數的不確定度還要大。由於三種核素的
相對原子質量 有著確高的準確度,所以晶體樣本的原子重量
A r 會經由計算得出。經由
A r 與測量出的樣本密度
ρ ,可得求阿伏伽德羅常量所需的摩爾體積:
其中M u 為摩爾質量常數。根據2014年CODATA的數值,矽的摩爾體積為12.058 832 14(61),相對標準不確定度為5.1×10-8 。
根據2010年CODATA的推薦值,透過
X射線 晶體密度法所得出的阿伏伽德羅常量,其相對不確定度為8.1×10
- 8 ,比電子質量法高,約為其一倍半。
國際組織 國際阿伏伽德羅協作組織(IAC),又稱“
阿伏伽德羅計畫 ”,是各國氣象局於1990年代初開始建立的協作組織,目標是透過X射線晶體密度法,將相對不確定度降低至低於2×10
- 8 的水平。這個計畫是千克新定義計畫的一部份,千克的新定義將會由通用的
物理常數 組成,取代現行的
國際千克原器 。而阿伏伽德羅計畫同時會與稱量千克原器的瓦特秤測量互補,共同提升
普朗克常數 的精確度。在現行的
國際單位制 (SI)定義下,測量阿伏伽德羅常量,就是間接地測量普朗克常數:
測量對象是一個受過高度打磨的矽制球體,重量為一千克整。使用球體是因為這樣做會簡化其大小的測量(因此密度也是),以及將無可避免的表面氧化層效應最小化。最早期的測量,用的是有著自然同位素成份的矽球,常數的相對不確定度為3.1×10-7 。這些最早期的數值,與從瓦特秤來的普朗克常數測量結果並不一致,儘管科學家們認為他們已經知道差異的成因。
早期數值的剩餘不確定性,來源為矽同位素構成的測量,這個測量是用於計算原子重量的,因此在2007年種出了一個4.8千克的同位素濃縮矽單晶(99.94%
28 Si),然後從中切割出兩個各一千克的球體。球體的直徑測量在重複時相差小於0.3
nm ,重量的不確定度為3
μg 。報告論文於2011年1月時發表,概括了國際阿伏伽德羅協作組織的研究結果,同時提交了對阿伏伽德羅常量的測量數值,為 6.022 140 78(1 8)×10
2 3 mol,與瓦特秤的數值一致,但更準確。
科學成就 阿伏伽德羅畢生致力於化學和物理學中關於原子論的研究。當時由於道耳頓和
蓋-呂薩克 的工作,
近代原子論 處於開創時期,阿伏伽德羅從
蓋-呂薩克定律 得到啟發,於1811年提出了一個對近代科學有深遠影響的假說:在相同的溫度和相同
壓強 條件下,相同體積中的任何氣體總具有相同的分子個數。但他這個假說卻長期不為科學界所接受,主要原因是當時科學界還不能區分分子和原子,同時由於有些分子發生了離解,出現了一些阿伏伽德羅假說難以解釋的情況。直到1860年,阿伏伽德羅假說才被普遍接受,後稱為阿伏伽德羅定律。它對科學的發展,特別是原子量的測定工作,起了重大的推動作用。
阿伏伽德羅常數
1摩爾的任何物質所含有的該物質的單位微粒數叫阿伏伽德羅常數,N A 值為6.02×102 3 。
阿伏伽德羅的重大貢獻,是他在1811年提出了一種
分子假說 :“同體積的氣體,在相同的溫度和
壓力 時含有相同數目的分子。”這一假說稱為阿伏伽德羅定律。這一假說是根據J.-L.蓋-呂薩克在1809年發表的氣體
化合體積定律 加以發展而形成的。阿伏伽德羅在1811年的著作中寫道:“蓋-呂薩克在他的論文裡曾經說,氣體化合時,它們的體積成簡單的比例。如果所得的產物也是氣體的話,其體積也是簡單的比例。這說明了在這些體積中所作用的分子數是基本相同的。由此必須承認,氣體物質化合時,它們的分子數目是基本相同的。”阿伏伽德羅還反對當時流行的氣體分子由單原子構成的觀點,認為
氮氣 、
氧氣 、氫氣都是由兩個原子組成的氣體分子。當時,化學界的權威
瑞典 化學家J.J.貝采利烏斯的電化學學說很盛行,在化學理論中占主導地位。電化學學說認為同種原子是不可能結合在一起的。因此,英、法、德國的科學家都不接受阿伏伽德羅的假說。一直到1860年歐洲100多位化學家在德國的卡爾斯魯厄舉行學術討論會,會上
康尼查羅 散發了一篇短文《化學哲學教程概要》,才重新提起阿伏伽德羅假說。這篇短文引起了J.L.邁爾的注意,他在1864年出版了《近代化學理論》一書,許多科學家從這本書里了解並接受了阿伏伽德羅假說。阿伏伽德羅定律已為全世界科學家所公認。阿伏伽德羅數是1摩爾物質所含的分子數,其數值是6.0221367×10
2 3 ,是自然科學的重要的基本常數之一。
數值測定 概述 阿伏伽德羅常數指摩爾微粒(可以是
分子 、
原子 、離子、電子等)所含的
微粒 的數目。阿伏加德羅常數一般取值為6.023×10
2 3 /mol。12.000g
1 2 C中所含
碳原子 的數目,因義大利化學家阿伏加德羅而得名具體數值是6.022 136 7×10
2 3 包含阿伏加德羅常數個微粒的物質的量是1mol.例如1mol鐵原子,質量為55.847g,其中含6.022 136 7×10
2 3 個鐵原子;1mol水分子的質量為18.010g,其中含6.022 136 7×10
2 3 個水分子;1mol鈉離子含6.022 136 7×10
2 3 個鈉離子;1mol電子含6.022 136 7×10
2 3 個電子。
這個常數可用很多種不同的方法進行測定例如
電化當量 法,
布朗運動 法油滴法,
X射線衍射法 ,
黑體 輻射法光
散射 法等。這些方法的理論根據各不相同,
2 3 ,1986年修訂為6.022 136 7×10
2 3 。
早在17-18世紀,西方的科學家就已經對6.02×102 3 這個數字有了初步的認識。他們發現,1個氫原子的質量等1g的1/6.02×102 3 。測定者是德國人約翰·洛施米特(Johann Josef Loschmidt)。因此此常數在一些國家(主要是說德語的國家)也叫洛施米特常數。
計算公式 1mol NaCl的體積為
而NaCl是立方晶體,四個NaCl分子所占的體積是(2d )3
1molNaCl的個數為V /[(2d )3 /4]=d 3
所以阿伏加德羅常數N A =M /2Pd 3
如果P 是原子密度,則八個原子所占的體積是(2d )3
故阿伏加德羅常數N A =M /2Pd 3
常數定律 在相同的溫度和壓強下,相同體積的任何氣體都含有相同數目的
分子 。
1.範圍:氣體(可為純淨物,也可以為混合物)
2.條件:同溫同壓同體積
1.p 1 V 1 /T 1 =p 2 V 2 /T 2
2.pV =nRT =mRT /M (R 為常數)
3.同溫同壓V 1 /V 2 =N 1 /N 2 =n 1 /n 2 ,p 1 /p 2 =n 1 /n 2 =N 1 /N 2
4.同溫同體積p 1 /p 2 =n1 /n2 =N 1 /N 2
5.同溫同壓同質量V 1 /V 2 =M 2 /M 1
6.同溫同壓同體積m 1 /m 2 =M 1 /M 2
測定原理 本實驗是用電解的方法進行測定阿伏伽德羅常數。
如果用兩塊已知質量的銅片分別作為
陰極 和
陽極 ,以CuSO
4 溶液作電解液進行電解,則在陰極上Cu
2 + 獲得電子後析出金屬銅,沉積在
銅片 上,使得其質量增加;在陽極上等量得金屬銅
溶解 ,生成Cu
2 + 進入溶液,因而銅片的質量減少。發生在陰極和陽極上的反應:
陰極反應:Cu
2 + +2e=
電解 =Cu ;
陽極反應 :Cu=
電解 =Cu
2 + +2e
陰極反應:二價
銅離子 得兩個電子生成銅(金屬單質態);陽極反應:銅(金屬單質態)被電解生成銅離子和兩個電子。
從理論上講,陰極上Cu
2 + 離子得到的
電子數 和陽極上Cu失去的電子數應該相等。因此在無副反應的情況下,陰極增加的質量應該等於陽極減少的質量。但往往因銅片不純,從陽極失去的重量要比陰極增加得質量偏高,所以從陽極
失重 算的得結果有一定誤差,一般從陰極增重的結果較為準確。
需要測量的量包括:電流強度I ,通電時間t ,陰極增重的質量m.
由於Cu的相對原子質量為64,而摩爾是由1 2 C的原子個數來定義的,故Cu的摩爾質量為64g/mol,由實驗步驟,可知陰極增重1mol即64g銅時,電量應為2mol。
根據上述分析,可以得到阿伏伽德羅常數的估計值約為32It /me ,其中e 為單個電子的電量。
測量歷史 測定阿伏加德羅常數: 已知NaCl晶體中靠的最近的Na+ 與Cl- 的距離為d ,其密度為ρ ,摩爾質量為M , 計算阿伏加德羅常數的公式: 1mol NaCl 的體積為 V =M /ρ , 而NaCl是立方晶體,四個NaCl分子所占的體積是(2d )3 , 1mol NaCl 的個數為V /[(2d )3 /4]=d 3 , 所以阿伏加德羅常數N A =4M /P (2d )3 。 如果ρ 是原子密度,則八個原子所占的體積是(2d )3 。 阿伏加德羅常數N A =M /Pd 3 。
早在17-18世紀,科學家們就已經對6.02×102 3 這個數字有了初步的認識。他們發現,1個氫原子的質量等於1克的6.02×102 3 分之1。但是直到19世紀中葉,“阿伏伽德羅常量”的概念才正式由法國科學家讓·貝漢(Jean Baptiste Perrin)提出,而在1865年,N A 的值才首次通過科學的方法測定出,測定者是德國人約翰·洛施米特(Johann Josef Loschmidt)。因此此常數在一些國家(主要是說德語的國家)也叫洛施米特常數。
正如先前所提及,阿伏伽德羅常量可以適用於任何物質,而不限於分子、原子或離子。因此,化學上利用這個數值來定義原子量或分子量。根據定義,阿伏伽德羅常量是組成與物質質量(用克表示)相等必要的原子或分子的數量。例如,鐵的原子量是55.845原子量單位,所以阿伏伽德羅常量的鐵原子(一摩爾的鐵原子)的質量是55.845克。反過來說,55.845克的鐵內有阿伏伽德羅常量的鐵原子。所以阿伏伽德羅常量是克和原子量的轉換係數。
1986年用X射線法測得的值是N A =6.022 136 7×102 3 mol- 1 。
已知m =M /N A (m 為一個微粒質量、M 為此微粒的摩爾質量、N A 為阿伏伽德羅常數),因此只要有物質的式量和質量,N A 的測量就並非難事。但由於N A 在化學中極為重要,所以必須要測量它的精確值。一般精確的測量方法是通過測量晶體(如晶體矽)的晶胞參數求得。由多國實驗室組成的國際阿伏伽德羅協作組織採用測量1個重1千克、幾乎完全由2 8 Si組成的晶體球的體積、晶胞參數等物理量的方法來精確地測定該值,以便用N A 來重新定義千克。
其它常量關係 阿伏伽德羅常量常作為其他常量之間的紐帶。如:
R =N A ×k
R 是氣體常數,k 是玻爾茲曼常數;
F =N A × e
F 是法拉第常數,e 是電荷量。
(法拉第常數F 是近代科學研究中重要的物理常數,代表每摩爾電子所攜帶的電荷,單位C/mol,它是阿伏伽德羅數N A =6.022 14×102 3 mol- 1 與元電荷e =1.602 176×10- 1 9 C的積。尤其在確定一個物質帶有多少離子或者電子時這個常數非常重要。法拉第常數以麥可·法拉第命名,法拉第的研究工作對這個常數的確定有決定性的意義。
一般認為此值是96 485.338 3±0.008 3C/mol,此值是由美國國家標準局所依據的電解實驗得到的,也被認為最具有權威性。
最早法拉第常數是在推導阿伏伽德羅數時通過測量電鍍時的電流強度和電鍍沉積下來的銀的量計算出來的。
在物理學和化學,尤其在電化學中法拉第常數是一個重要的常數。它是一個基本常數,其值只隨其單位變化。在電解、電鍍、燃料電池和電池等涉及到物質與它們的電荷的工藝中法拉第常數都是一個非常重要的常數。因此它也是一個非常重要的技術常數。
在計算每摩爾物質的能量變化時也需要法拉第常數,一個例子是計算一摩爾電子在電壓變化時獲得或者釋放出的能量。在實際套用中法拉第常數用來計算一般的反應係數,比如將電壓演算為自由能。)
阿伏伽德羅 阿伏伽德羅 (Ameldeo Avogadro,1776~1856)義大利自然科學家。1776年8月9日生於都靈的一個貴族家庭,早年致力於法學工作。1796年得法學博士後曾任地方官吏。他從1800年起開始自學數學和物理學。1803年發表了第一篇科學論文。1809年任末爾利學院自然哲學教授。1820年都靈大學設立了義大利的第一個物理講座,他被任命為此講座的教授,1822年由於政治上的原因,這個講座被撤銷,直到1832年才恢復,1833年阿伏伽德羅重新擔任此講座的教授,直到1850年退休。1856年7月9日在阿伏伽德羅在都靈逝世。終年80歲。
阿伏伽德羅常數 阿伏伽德羅一生從不追求名譽地位,只是默默地埋頭於科學研究工作中,並從中獲得了極大的樂趣。
阿伏伽德羅早年學習法律,又做過地方官吏,後來受興趣指引,開始學習數學和物理,並致力於原子論的研究,他提出的分子假說,促使道爾頓原子論發展成為原子——分子學說。使人們對物質結構的認識推進了一大步。但遺憾的是,阿伏伽德羅的卓越見解長期得不到化學界的承認,反而遭到了不少科學家的反對,被冷落了將近半個世紀。
由於不採納分子假說而引起的混亂在當時的化學領域中非常嚴重,各人都自行其事,碳的原子量有定為6的,也有定為12的,水的化學式有寫成HO的,也有寫成H2 O的,醋酸的化學式竟有19種之多。當時的雜誌在發表化學論文時,也往往需要大量的注釋才能讓人讀懂。一直到了近50年之後,德國青年化學家邁耶爾認真研究了阿伏伽德羅的理論,於1864年出版了《近代化學理論》一書。許多科學家從這本書里,懂得並接受了阿伏伽德羅的理論,才結束了這種混亂狀況。
人們為了紀念阿伏伽德羅,把1摩爾任何物質中含有的微粒數N A =6.02×102 3 ,稱為阿伏伽德羅常數。
12克1 2 C含有的碳原子個數稱為阿伏加德羅常數,用N A 表示,單位是個/摩。1摩爾任何物質均含N A 個微粒。N A 的近似數值為6.02 205×102 3 mol- 1 ,可通過單分子膜法、電解法等測出。

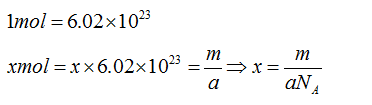
 阿伏伽德羅常數
阿伏伽德羅常數
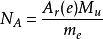


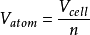


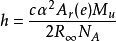
 阿伏伽德羅常數
阿伏伽德羅常數
