在原子核附近出現的機率較大的電子,可更多地避免其餘電子的排斥,受到核的較強的吸引而更靠近核,這種進入原子內部空間的作用叫做鑽穿效應(penetration effect),鑽穿效應可以使能級降低。
基本介紹
- 中文名:鑽穿效應
- 外文名:penetration effect
- 含義:進入原子內部空間的作用
- 鑽穿能力:ns > np > nd > nf
- 作用:降低能級
基本性質
定性判斷
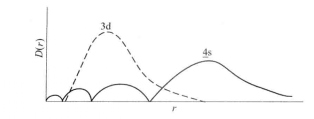 4s和3d的徑向分布函式
4s和3d的徑向分布函式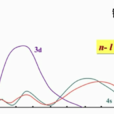
在原子核附近出現的機率較大的電子,可更多地避免其餘電子的排斥,受到核的較強的吸引而更靠近核,這種進入原子內部空間的作用叫做鑽穿效應(penetration effect),鑽穿效應可以使能級降低。
 4s和3d的徑向分布函式
4s和3d的徑向分布函式在原子核附近出現的機率較大的電子,可更多地避免其餘電子的排斥,受到核的較強的吸引而更靠近核,這種進入原子內部空間的作用叫做鑽穿效應(penetration effect),鑽穿...
1 舉例 2 規律總結 3 鑽穿效應 4 近似能級圖 能級交錯舉例 編輯 過渡元素鈧的外層電子排布為4s^2 ∣3d^1,失去電子時,按能級交錯應先失去3d電子,成為4s...
由於l不同,軌道電子云徑向分市不同,電子云鑽到核附近的幾牢不同,因而引起軌道能量不同的現象稱為鑽穿效應。在多電子原子中,每個電子既被其它電子所禁止,同時又...
鮑林近似能級圖外層電子鑽到內部空間而靠近原子核的現象,通常稱為鑽穿作用。...... 3、鑽穿效應:外層電子鑽到內部空間而靠近原子核的現象,通常稱為鑽穿作用。由於...
同一電子層之間有電子的相互作用,不同電子層之間也有相互作用,這種相互作用稱為“鑽穿效應”。其原理較為複雜,鑽穿效應的直接結果就是上一電子層的d能級的能量...
對單電子原子(H原子),因無鑽穿效應、禁止效應等電子間的相互作用,其軌道能量僅決定於主量子數n,則2Px,2Py,2Pz為一組簡併軌道。...
鑭系收縮,第二、三過渡系同族元素原子半徑很接近。4f電子禁止作用較弱,6s電子的鑽穿效應增強,表現“惰性電子對效應”,6s電子較難電離。...
1.3多電子原子中的“能級交錯”、“禁止效應”、“鑽穿效應” 1.4核外電子排布的三原則 1.5美國AP課程精選習題與解答 2走近社會和生活 2.1原子結構與光譜 2....
2.5.1 禁止效應和鑽穿效應2.5.2 多電子原子核外電子構型2.6 元素周期表與核外電子構型2.6.1 周期與核外電子構型2.6.2 族與核外電子構型...
9.4.1 禁止效應和鑽穿效應190 9.4.2 鮑林近似能級圖192 9.4.3 核外電子排布規則193 9.5 原子的電子結構與元素周期系196 9.5.1 原子結構與元素周期表19...
