《鐵、銅及其化合物的套用》是一本高中化學科目的教材。
基本介紹
- 中文名:鐵、銅及其化合物的套用
- 屬性:礦物
- 套用學科:高中化學
重要說明,教材分析,教材的地位和作用,教學目標,重點與難點,教學方法分析,教學程式的設計,板書設計,簡單教學流程,教學反思,
重要說明
此教學設計任務由南京曉莊學院現代教育技術課程老師yqiong參與教師-維基星光計畫進行wiki教學而發布。此詞條為由吳學芳選定主題並負責、參與現代教育技術課程的所有同學協作共同完成!
教材分析
教材的地位和作用
鐵、銅及其化合物的套用是高中化學必修Ⅰ專題3第二單元第二節的內容,是繼礦物中的鋁及其化合物學習之後,向學生介紹的另外兩種重要的可從礦物中得到的基礎材料。學習本節內容,可為以後更好的學習其他金屬的性質以及各種反應和規律打下良好的基礎。
教學目標
根據新課標的評價建議及教學目標的要求,結合本教材的內容及學生特點,本節課的目標如下:
(1)知識和技能
①了解鐵、銅的物理性質,掌握鐵、銅的化學性質。
②掌握Fe2+、Fe3+的性質及相互轉化,學會用化學方法鑑別Fe2+、Fe3+。
(2)過程和方法
①通過演示實驗,鍛鍊觀察的能力,學會分析問題的方法。
②通過列表比較和圖示聯繫的方法,在掌握Fe2+、Fe3+的性質的同時學習科學的思維方法和學習方式。
(3)情感、態度和價值觀
通過本節鐵銅這些常見元素及其化合物在生活中的套用的學習,進一步深切認識到化學與生活的密切關係,學會用化學知識解釋或解決身邊與化學相關的問題。
(1)知識和技能
①了解鐵、銅的物理性質,掌握鐵、銅的化學性質。
②掌握Fe2+、Fe3+的性質及相互轉化,學會用化學方法鑑別Fe2+、Fe3+。
(2)過程和方法
①通過演示實驗,鍛鍊觀察的能力,學會分析問題的方法。
②通過列表比較和圖示聯繫的方法,在掌握Fe2+、Fe3+的性質的同時學習科學的思維方法和學習方式。
(3)情感、態度和價值觀
通過本節鐵銅這些常見元素及其化合物在生活中的套用的學習,進一步深切認識到化學與生活的密切關係,學會用化學知識解釋或解決身邊與化學相關的問題。
重點與難點
重點:Fe2+、Fe3+的性質;鐵鹽和亞鐵鹽的轉變;Fe2+、Fe3+的檢驗
難點:二價鐵和三價鐵[與前一致,用符號表示。下同]的相互轉化
難點:二價鐵和三價鐵[與前一致,用符號表示。下同]的相互轉化
教學方法分析
俗話說,“教學有法、教無定法”,結合化學新教材的編寫特點,我在教學過程中進行了如下嘗試:
對鐵和銅的物理、化學性質的學習,採用回憶歸納法,學生通過生活中對鐵銅的了解以及之前的學習,歸納它們的性質,然後老師做一定講解與總結。
Fe2+、Fe3+的性質和檢驗是本節課的重點,採用問題引入,提出問題,採用討論、探究實驗等方式,來找到解決問題的方法,從而加深學生對相關知識的認識。
二價鐵和三價鐵的相互轉化是本節課的難點,關於二價鐵和三價鐵的相互轉化的教學,啟發學生運用氧化還原的觀點理解轉化的實質,用離子方程式表示反應過程。增加了二價鐵離子與三價鐵離子相互轉化的探究實驗方案設計,並組織學生對設計的方案進行評價,並動手操作,記錄實驗現象,培養學生的創新意識。
在理解了二價鐵和三價鐵的相互轉化的基礎上,三價鐵離子的檢驗可由學生直接回答,進而提出二價鐵的檢驗,要求學生設計實驗方案,實際操作,觀察分析實驗,以求學會運用所學知識解決實際問題。
綜合以上教學手段,我本節課的教學方法是:啟發式教學法,實驗探究法,討論法。
對鐵和銅的物理、化學性質的學習,採用回憶歸納法,學生通過生活中對鐵銅的了解以及之前的學習,歸納它們的性質,然後老師做一定講解與總結。
Fe2+、Fe3+的性質和檢驗是本節課的重點,採用問題引入,提出問題,採用討論、探究實驗等方式,來找到解決問題的方法,從而加深學生對相關知識的認識。
二價鐵和三價鐵的相互轉化是本節課的難點,關於二價鐵和三價鐵的相互轉化的教學,啟發學生運用氧化還原的觀點理解轉化的實質,用離子方程式表示反應過程。增加了二價鐵離子與三價鐵離子相互轉化的探究實驗方案設計,並組織學生對設計的方案進行評價,並動手操作,記錄實驗現象,培養學生的創新意識。
在理解了二價鐵和三價鐵的相互轉化的基礎上,三價鐵離子的檢驗可由學生直接回答,進而提出二價鐵的檢驗,要求學生設計實驗方案,實際操作,觀察分析實驗,以求學會運用所學知識解決實際問題。
綜合以上教學手段,我本節課的教學方法是:啟發式教學法,實驗探究法,討論法。
教學程式的設計
活動一:鐵銅的物理性質
引入:鐵和銅是我們日常生活中經常接觸到的金屬材料,鐵和銅的許多套用是由它的物理性質決定的,大家能根據它們生活中的套用說出它們的物理性質嗎?
學生回答,老師總結。
設計意圖:自然導課,讓學生回憶總結,激發興趣,激活思維。老師總結後更印象深刻。
活動二:鐵銅的化學性質
過渡:了解了它們的物理性質,我們再來看一下化學性質,在之前的學習中,我們已經學習了很多鐵銅與其它物質發生的反應,請同學們回憶並回答。
學生回答完畢後,老師做一定的講解並總結。
設計意圖:讓學生自己回憶總結更能激發興趣,鞏固已學知識。經老師講解總結找到共鳴,享受成功樂趣,提高學習興趣。
活動三:Fe2+與Fe3+的性質及相互轉化
引入:這是從實驗室拿來的一瓶硫酸亞鐵溶液,(展示)為什麼會變成了淺淺的黃色的?我們將在接下來學習中找到答案。
我們知道,鐵既可以生成Fe2+又可以生成Fe3+,那么Fe2+與Fe3+有何區別呢?請同學們用實驗方法鑑別FeCl3溶液和FeCl2溶液?
探究一:Fe2+與Fe3+的性質有何不同?
(引導學生討論,得出設計實驗方案,然後進行一系列演示和分組實驗驗證)
學生實驗一:在兩支試管中分別加入FeCl3溶液和0.1mol/LFeCl2溶液,觀察溶液的顏色。
學生回答:Fe2+溶液呈淺綠色,Fe3+溶液呈棕黃色。
學生實驗二:向兩支試管中分別滴加2滴KSCN溶液,觀察溶液顏色的變化。
引導學生分析實驗二得:Fe3+遇到KSCN溶液變成血紅色,Fe2+遇KSCN溶液不顯血紅色。我們可以利用這一反應檢驗Fe3+的存在。
教師指導下書寫離子方程式:
Fe3++3SCN—-=Fe(SCN)3
學生實驗三:在試管里注入少量FeCl3溶液,再逐滴滴入NaOH溶液。觀察發生的現象。
引導分析實驗三得:溶液里立即生成了紅褐色的Fe(OH)3沉澱。
教師指導下書寫離子方程式:Fe3++3OH-=Fe(OH)3↓
學生實驗四:在試管里注入少量新製備的FeSO4溶液,用膠頭滴管吸取NaOH溶液,將滴管尖端插入試管里溶液底部,慢慢擠出NaOH溶液,觀察發生的現象。
分析實驗四得:擠入NaOH溶液後,開始時析出一種白色的絮狀沉澱,這是氫氧化亞鐵〔Fe(OH)2〕。生成的白色沉澱迅速變成灰綠色,最後變成紅褐色。(實際操作中這一現象可能很難產生,可帶領學生分析原因)
教師指導下書寫離子方式:Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
設計意圖:
1通過此實驗讓學生了解Fe2+與Fe3+的性質的不同,知道它們可以相互轉化,從而引出轉化的條件,自然進入下一個知識點的學習。
2通過實驗讓學生更直觀的了解Fe2+與Fe3+的性質的不同,使學習效果更佳。
過渡:在剛才做的實驗中,白色的Fe(OH)2(為+2價鐵)被空氣里的氧氣氧化成了紅褐色的Fe(OH)3(為+3價鐵)。那么,鐵鹽和亞鐵鹽是如何相互轉變的呢,下面我們共同探究鐵鹽和亞鐵鹽轉化的條件。
探究二:鐵鹽和亞鐵鹽轉化的條件?
1、根據氧化還原反應基本原理,教師引導學生提出轉化的條件
Fe2+→Fe3+:化合價,被,需要加入。如:Cl2
Fe3+→Fe2+:化合價,被,需要加入。如:Fe
2、學生討論,設計實驗方案,進行分組實驗並記錄現象,教師巡視
最後由學生總結歸納結論要點,嘗試用簡潔的圖示方法自主構建“鐵三角”關係。
過渡:物質的特性決定了物質的檢驗,那么如何檢驗Fe2+與Fe3+?
學生回答檢驗Fe3+的方法。
探究三:如何檢驗未知溶液中是否存在Fe2+?
學生得出實驗方案:加入KSCN溶液無紅色,再加入氯水呈紅色,說明有Fe2+
過渡:不同價態的鐵離子之間的相互轉化,在生活、生產和科學研究中有著廣泛的套用。
用FeCl3溶液可以腐蝕印刷線路板(Cu)請解釋其原因寫出相關的離子方程式。
學生上黑板寫方程式。
設計意圖:讓學生鍛鍊運用學習的不同價態的鐵離子的性質來解釋身邊與之相關的問題。
[問題解決]硫酸亞鐵溶液為什麼會變成了淺淺的黃色的?
1、你能驗證你的想法嗎?
2、應該如何處理這瓶變黃的硫酸亞鐵溶液呢?(寫出該反應的離子方程式)
3、你能告訴老師如何配置硫酸亞鐵溶液嗎?
思考題:除去FeCl2溶液中少量的FeCl3與FeCl3溶液中少量的FeCl2分別可用什麼試劑,寫出相應的離子方程式。
設計意圖:
1與前面內容相對照,運用學過的知識解釋相關的現象。
2學會用學過的知識來解決問題,從而更好的鞏固消化。
引入:鐵和銅是我們日常生活中經常接觸到的金屬材料,鐵和銅的許多套用是由它的物理性質決定的,大家能根據它們生活中的套用說出它們的物理性質嗎?
學生回答,老師總結。
設計意圖:自然導課,讓學生回憶總結,激發興趣,激活思維。老師總結後更印象深刻。
活動二:鐵銅的化學性質
過渡:了解了它們的物理性質,我們再來看一下化學性質,在之前的學習中,我們已經學習了很多鐵銅與其它物質發生的反應,請同學們回憶並回答。
學生回答完畢後,老師做一定的講解並總結。
設計意圖:讓學生自己回憶總結更能激發興趣,鞏固已學知識。經老師講解總結找到共鳴,享受成功樂趣,提高學習興趣。
活動三:Fe2+與Fe3+的性質及相互轉化
引入:這是從實驗室拿來的一瓶硫酸亞鐵溶液,(展示)為什麼會變成了淺淺的黃色的?我們將在接下來學習中找到答案。
我們知道,鐵既可以生成Fe2+又可以生成Fe3+,那么Fe2+與Fe3+有何區別呢?請同學們用實驗方法鑑別FeCl3溶液和FeCl2溶液?
探究一:Fe2+與Fe3+的性質有何不同?
(引導學生討論,得出設計實驗方案,然後進行一系列演示和分組實驗驗證)
學生實驗一:在兩支試管中分別加入FeCl3溶液和0.1mol/LFeCl2溶液,觀察溶液的顏色。
學生回答:Fe2+溶液呈淺綠色,Fe3+溶液呈棕黃色。
學生實驗二:向兩支試管中分別滴加2滴KSCN溶液,觀察溶液顏色的變化。
引導學生分析實驗二得:Fe3+遇到KSCN溶液變成血紅色,Fe2+遇KSCN溶液不顯血紅色。我們可以利用這一反應檢驗Fe3+的存在。
教師指導下書寫離子方程式:
Fe3++3SCN—-=Fe(SCN)3
學生實驗三:在試管里注入少量FeCl3溶液,再逐滴滴入NaOH溶液。觀察發生的現象。
引導分析實驗三得:溶液里立即生成了紅褐色的Fe(OH)3沉澱。
教師指導下書寫離子方程式:Fe3++3OH-=Fe(OH)3↓
學生實驗四:在試管里注入少量新製備的FeSO4溶液,用膠頭滴管吸取NaOH溶液,將滴管尖端插入試管里溶液底部,慢慢擠出NaOH溶液,觀察發生的現象。
分析實驗四得:擠入NaOH溶液後,開始時析出一種白色的絮狀沉澱,這是氫氧化亞鐵〔Fe(OH)2〕。生成的白色沉澱迅速變成灰綠色,最後變成紅褐色。(實際操作中這一現象可能很難產生,可帶領學生分析原因)
教師指導下書寫離子方式:Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
設計意圖:
1通過此實驗讓學生了解Fe2+與Fe3+的性質的不同,知道它們可以相互轉化,從而引出轉化的條件,自然進入下一個知識點的學習。
2通過實驗讓學生更直觀的了解Fe2+與Fe3+的性質的不同,使學習效果更佳。
過渡:在剛才做的實驗中,白色的Fe(OH)2(為+2價鐵)被空氣里的氧氣氧化成了紅褐色的Fe(OH)3(為+3價鐵)。那么,鐵鹽和亞鐵鹽是如何相互轉變的呢,下面我們共同探究鐵鹽和亞鐵鹽轉化的條件。
探究二:鐵鹽和亞鐵鹽轉化的條件?
1、根據氧化還原反應基本原理,教師引導學生提出轉化的條件
Fe2+→Fe3+:化合價,被,需要加入。如:Cl2
Fe3+→Fe2+:化合價,被,需要加入。如:Fe
2、學生討論,設計實驗方案,進行分組實驗並記錄現象,教師巡視
最後由學生總結歸納結論要點,嘗試用簡潔的圖示方法自主構建“鐵三角”關係。
過渡:物質的特性決定了物質的檢驗,那么如何檢驗Fe2+與Fe3+?
學生回答檢驗Fe3+的方法。
探究三:如何檢驗未知溶液中是否存在Fe2+?
學生得出實驗方案:加入KSCN溶液無紅色,再加入氯水呈紅色,說明有Fe2+
過渡:不同價態的鐵離子之間的相互轉化,在生活、生產和科學研究中有著廣泛的套用。
用FeCl3溶液可以腐蝕印刷線路板(Cu)請解釋其原因寫出相關的離子方程式。
學生上黑板寫方程式。
設計意圖:讓學生鍛鍊運用學習的不同價態的鐵離子的性質來解釋身邊與之相關的問題。
[問題解決]硫酸亞鐵溶液為什麼會變成了淺淺的黃色的?
1、你能驗證你的想法嗎?
2、應該如何處理這瓶變黃的硫酸亞鐵溶液呢?(寫出該反應的離子方程式)
3、你能告訴老師如何配置硫酸亞鐵溶液嗎?
思考題:除去FeCl2溶液中少量的FeCl3與FeCl3溶液中少量的FeCl2分別可用什麼試劑,寫出相應的離子方程式。
設計意圖:
1與前面內容相對照,運用學過的知識解釋相關的現象。
2學會用學過的知識來解決問題,從而更好的鞏固消化。
板書設計
鐵、銅及其化合物的套用 一、鐵銅的物理性質 二、鐵銅的化學性質 三、Fe2+與Fe3+的性質比較 四、Fe2+與Fe3+的相互轉變 1、Fe2+→Fe3+:化合價,被,需要加入。如:Cl2 Fe3+→Fe2+:化合價,被,需要加入。如:Fe 2、“鐵三角” 五、Fe2+與Fe3+的檢驗
簡單教學流程
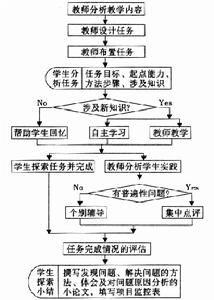 流程
流程教學反思
本節課涉及到很多學生歸納總結的部分,學生能否準確表述,需要老師準確的引導和點評。
