基本介紹
- 中文名:鋰化反應
- 外文名:lithiation
- 用途:有機合成
簡介,概述,性質,製備,套用,與含活潑氫化合物的反應,與含不飽和鍵化合物的加成反應,與鹵代烴申鹵素的交換反應,
簡介
概述
鋰化反應是有機化合物分子中的氫被鋰取代的反應。並於1930年套用於有機合成以來,人們對它進行了長期、深入地研究。它在有機化學理論研究和有機合成中的套用方面都起著重要的作用。ziegler發現的有機鋰化合物在有機合成上與有機鎂化合物(GdgnaId)具有相似的性質和套用價值,並且在某些方面與GdgnaId試劑相比,具有反應活性更強、產率高、還原傾向較小、產容易分離、能夠溶於多種非極性溶劑等特點,從而在有機合成中可以代替GdgnaId或彌補Gdgnard試劑在某些合成上的不足。同時,有機鋰化合物在一些有機合成中具有獨特的性能,使得它在有機合成中具有廣泛的套用價值和重要的意義。
性質
有機鋰化合物是重要的第1 A族的金屬有機化合物,這族元素是元素中正電性最強的一族。鋰與碳的電負性相差較大,形成的化學鍵極性大(根據PauliTlg方法計算,C—Li鍵則有43%的離子性),使電子云較多的集中在碳原子上,這種電子的分布決定了有機鋰化合物的強親核性和強鹼性的特徵。
有機鋰化合物很容易締合,主要原因是由於C—Li鍵的強烈極化,再加上鋰原子的體積小,所以它在結晶體或溶液中,往往是以多分子的聚集體形式存在。簡單的有機鋰化合物(烷基鋰)在苯、環己烷等烴類溶劑中,用冰點下降的方法研究證明是以六聚體的形式存在;在乙醚等普通溶劑中,以四聚體的形式存在。在乙醚中烷基鋰的結構已用C13一“Li7 NMR耦合獲得的證據證明是四面體,四個鋰原子在四面體的四個頂點,每個烷基直接穿過四面體每個面的中心。在結晶體中烷基鋰的聚集體可用X一射線結晶學研究及測定證明其立體結構。總之,用X一射線和測定分子量可以確定它們的締合度和聚集體的立體結構。
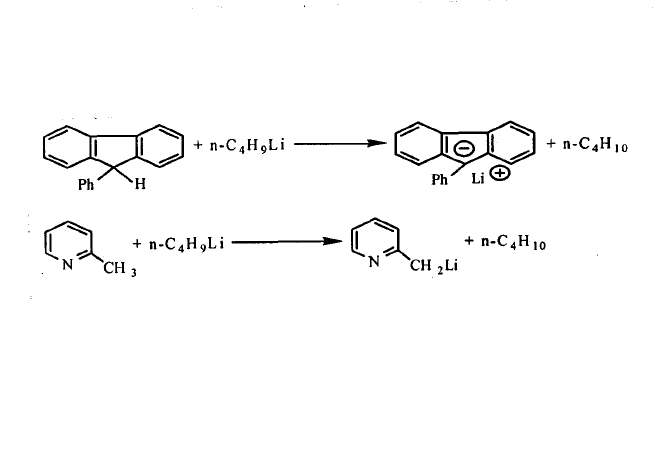
有機鋰化合物的反應活性與分子的締合度有很大的關係,締合作用降低了有機鋰化合物的反應活性,人們在研究過程中,觀察到某些高度位阻的有機鋰化合物的反應活性反而比更簡單的有機鋰化合物大,這主要是由於烴基的空間位阻妨礙了聚集體的形成,如苄基鋰在四氫呋喃中以單體存在,與同一反應物的反應速率是四聚體甲基鋰的104倍。要增大其反應活性,一般是在聚集態的有機鋰化合物中加入適量的Lewis鹼,使其解聚而形成單體有機鋰化合物與Lewis鹼的配合物,由於Lewis鹼與金屬鋰發生配位作用,使C—Li鍵的極性增強,進一步提高了有機鋰化合物的反應活性。例如,正丁基鋰的四氫呋喃溶液一般不易使甲苯發生金屬化反應,如果加入適量的N,N,N’,N’一四甲基乙二胺(TMEDA),則正丁基鋰的聚集體轉變成單體配合物,反應活性增強,可使甲苯的金屬化反應迅速進行。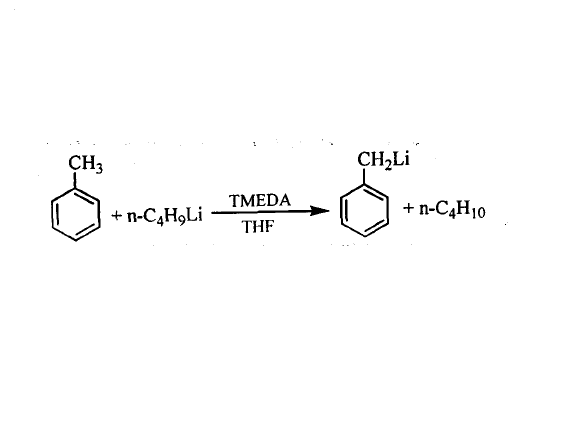 甲苯發生金屬化
甲苯發生金屬化
 甲苯發生金屬化
甲苯發生金屬化製備
1、鹵代烴與金屬鋰作用
用烷基或芳基鹵化物,在適當的非極性溶劑(苯、環己烷、四氫呋喃、戊烷、乙醚、石油醚等)中,與金屬鋰直接作用,即可得到有機鋰化合物。此法在1929年發現的。反應式如圖: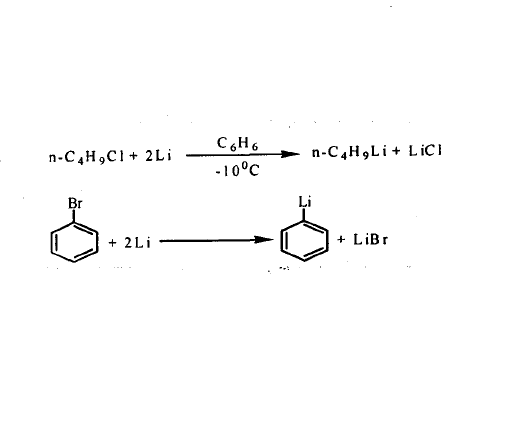 鹵代烴與金屬鋰作用
鹵代烴與金屬鋰作用
 鹵代烴與金屬鋰作用
鹵代烴與金屬鋰作用2、烯烴與金屬鋰的加成
用金屬鋰與烯烴碳碳雙鍵的加成,可製得有機鋰化合物。尤其是當碳碳雙鍵與芳基或不飽和鍵處於共軛的情況下更容易發生加成,得到有機鋰化合物。反應式如圖: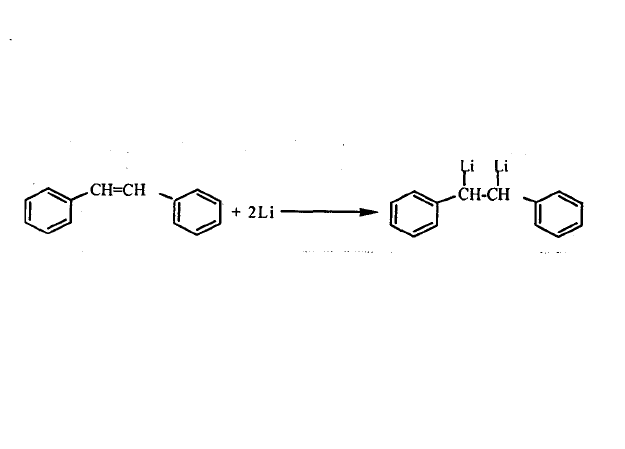 烯烴與金屬鋰的加成
烯烴與金屬鋰的加成
 烯烴與金屬鋰的加成
烯烴與金屬鋰的加成3、化合物之間的交換反應
由金屬一金屬的交換反應製備:
如要製備元鹵化鋰的純度較高的有機鋰化合物,可由有機汞化合物與金屬鋰通過金屬一金屬交換反應製備。如:
R2Hg十2Li一2RLi+Hg
有機汞化合物是較好的原料,因為有機汞化合物容易製備和精製;生成的汞與過剩的金屬鋰生成鋰汞齊,使產物較易分離。如要製備乙烯型的鋰化合物,可用有機錫化合物與有機鋰化合物的金屬交換反應製備。利用這一方法可以製備一些結構更為複雜的乙烯型的鋰化合物。
由金屬一鹵素的交換反應製備:
鹵代烴中的鹵素與有機鋰化合物中的鋰發生交換反應,製備相應的有機鋰化合物。常用的有機鋰化合物是可直接製取的苯基鋰和正丁基鋰等。例如: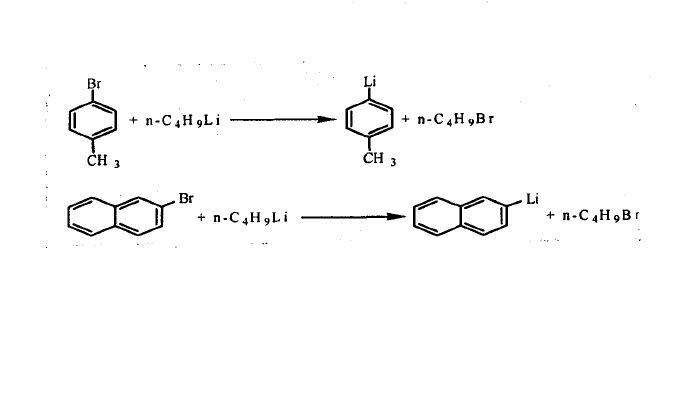 金屬一鹵素的交換
金屬一鹵素的交換
 金屬一鹵素的交換
金屬一鹵素的交換由氫一金屬的交換反應制各:
烷基鋰(常用正丁基鋰)與某些化合物中的氫發生交換反應,製備這些化合物相應的有機鋰化合物。例如: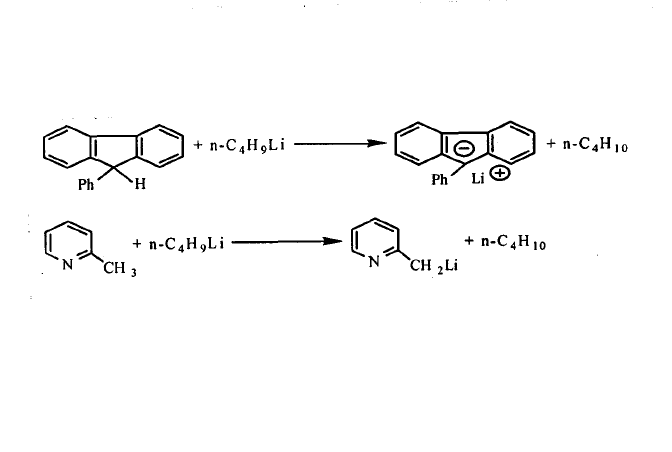 氫一金屬的交換
氫一金屬的交換
 氫一金屬的交換
氫一金屬的交換用金屬一金屬、金屬一鹵素和氫一金屬交換反應:
來製備一些有機鋰化合物是非常重要的途徑,通常可以製備前兩種方法不易直接製取的有機鋰化合物。例如,鄰溴苯酚直接與金屬鋰反應,只能得到鋰鹽,若與有機鋰化合物作用,通過交換反應即可製得。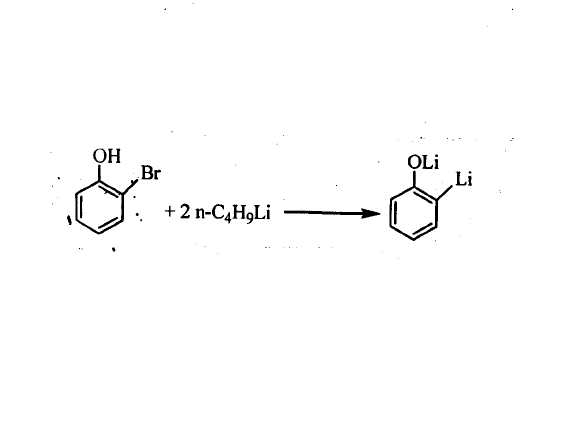 鄰溴苯酚與金屬鋰反應
鄰溴苯酚與金屬鋰反應
 鄰溴苯酚與金屬鋰反應
鄰溴苯酚與金屬鋰反應套用
與含活潑氫化合物的反應
有機鋰試劑可與含活潑氫的化合物,如水、醇、硫醇、胺、羧酸及含活潑氫的烴等反應。例如:
RLi十H20—RH+Li0H
RLi+R,0H—RH+R’0Li
這個反應可以用來合成相應的烴類化合物,但這一反應更重要的作用在於合成其它化合物或試劑上的套用。例如,在有機合成中極為有用的試劑G.wittig試劑,就是通過有機鋰試劑的這一性質來製取的,用過量的鹵化物處理三苯膦得到季鐮鹽,再用有機鋰試劑(如苯基鋰)處理,從a一碳原子上奪取一個質子生成wittig試劑。
與含不飽和鍵化合物的加成反應
有機鋰試劑與醛、酮的羰基發生親核加成反應,經水解可合成各種醇類化合物。它可以代替GdgnaId試劑與醛酮反應合成醇,特別是與位阻酮的加成更顯示了它的優越性,並且它的還原傾向更小。例如,乙基鋰和乙基溴化鎂分別與金剛烷酮作用,前者主要得到2一乙基一2一金剛烷醇,即加成產物——叔醇;而後者主要得到2一金剛烷醇,即還原產物——仲醇。對於空問位阻較大的叔丁基鋰也能與金剛烷酮發生加成,生成高度擁擠的2一叔丁基一2一金剛烷醇(叔醇)。反應式如下: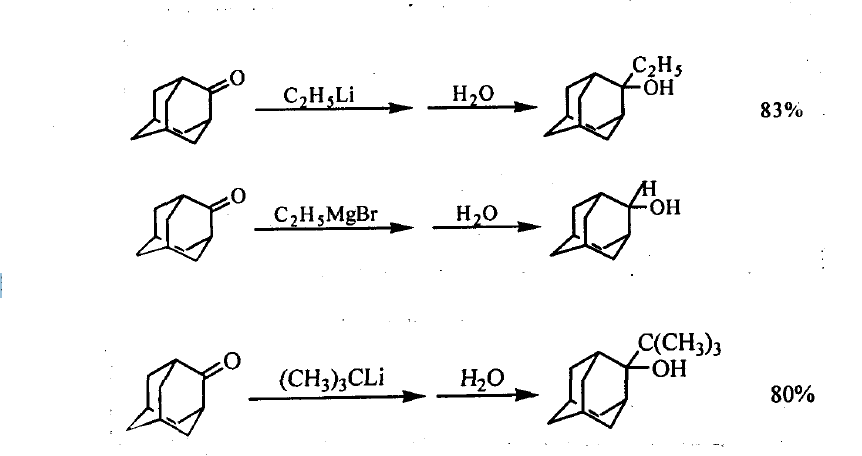 加成反應
加成反應
 加成反應
加成反應有機鋰試劑與酯類化合物中的碳氧雙鍵發生加成反應,先得到酮,酮繼續與有機鋰試劑作用,得到叔醇。若用兩摩爾的有機鋰試劑與一摩爾的酯作用可合成叔醇,這是合成兩個烴基相同叔醇的一種較好方法。還可套用α一鋰代羧酸鋰鹽與酯類的碳氧雙鍵發生加成,尤其是與α,β一不飽和酸醑發生麥可類型的加成反應,合成取代的二元羧酸及其酯。
與鹵代烴申鹵素的交換反應
有機鋰試劑與鹵代烴中的鹵素髮生交換反應。
RLi+R’X—RX+R’Li
這類反應自Wittig和Gilman發現以來,在有機合戒中起著非常重要的作用。通過這類反應可製得某些在有機合成中非常有用的有機鋰試劑。有機雜環化合物的鹵化反應比較容易,將鹵代雜環化合物通過交換反應得到雜環的有機鋰試劑,而套用於雜環衍生物的合成。例如,將鹵代雜環化合物通過交換反應得到雜環的有機鋰試劑,而套用於雜環衍生物的合成。