基本介紹
- 中文名:鋅銅電池
- 別名:丹尼爾電池
- 發明人:John Frederic Daniell
- 發明時間:1836年
簡介

熱力學理論



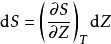









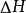




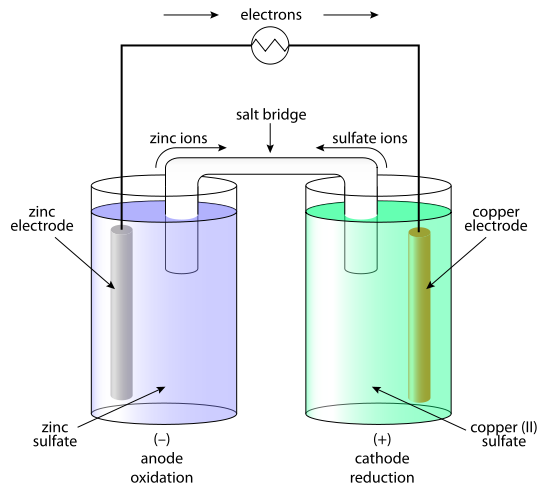




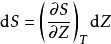









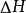




鋅銅電池又稱丹尼爾電池,是一種以鋅為負電極;銅為正電極;硫酸鋅與硫酸銅為電解液的電化電池,由約翰·弗雷德里克·丹尼爾(John Frederic Daniell)於1836年發明,...
銅、鋅兩電極,一同浸入稀硫酸時,由於鋅比銅活潑,容易失去電子,鋅被氧化成二價鋅進入溶液,電子由鋅片通過導線流向銅片,溶液中的氫離子從銅片獲得電子,被還原成氫...
土豆電池的工作原理主要是兩個電極一邊是銅,一邊是鋅(鐵,錫都行)土豆提供化學反應需要的酸液,金屬鋅的化學性質比銅更活潑,當這兩種金屬同時處在酸液中時,鋅...
他又用不同的金屬進行實驗,發現銅和鋅是最合適的金屬,並發明了伏特電池,而伏特電池即為現在的原電池的原型。 [1] 中文名 伏特電池 外文名 Voltaic Cell ...
原電池放電時,負極發生氧化反應,正極發生還原反應。例如銅鋅原電池又稱丹聶爾電池,其正極是銅極,浸中硫酸銅溶液中;負極是鋅板,浸在硫酸鋅溶液中。兩種電解質...
鋅-空氣電池也稱為鋅-氧空氣電池,是一種體積小、電荷容量大、質量小、能在寬廣的溫度範圍內正常工作、無腐蝕且工作安全可靠的環保電池。...
電池 源。1836年,英國的丹尼爾對“伏特電堆”進行了改良。他使用稀硫酸作電解液,解決了電池極化問題,製造出第一個不極化,能保持平衡電流的鋅─銅電池此後,這些電...
在電化學電池中,發生氧化反應的電極稱為陽極,發生還原反應的電極稱為陰極。在右圖所示的銅-鋅原電池中,陽極和陰極上發生的氧化還原反應如下:...
電池使用氫氧化鉀(KOH)或氫氧化鈉(NaOH)的水溶液做電解質液,採用了與鋅錳電池相反的負極結構,負極在內為膏狀膠體,用銅釘做集流體,正極在外,活性物質和導電...
鹼性鋅錳電池是以鋅為負極,二氧化錳為正極,氫氧化鈉或氫氧化鉀為電解質,採取反極式結構製成的電池。...
高鐵作為電池的正極材料時, 該電極反應為三電子反應, 電池的電勢以及能量都比傳統的鋅錳電池高。而且這種材料價格低廉對環境無污染, 因此受到電化學界的廣泛注意。...
碳性電池全稱:中性鋅-二氧化錳乾電池(zinc-manganese dry battery),屬於化學電源中的原電池,是一種一次性電池。因為這種化學電源裝置其電解質是一種不能流動的糊狀...
常見的有普通鋅-錳乾電池、鹼性鋅-錳乾電池、鎂-錳乾電池、鋅-空氣電池、鋅-氧化汞電池、鋅-氧化銀電池、鋰-錳電池等。對於使用最多的鋅-錳乾電池來說,由於...
丹尼爾電池就是將Zn(鋅)置於ZnSO4(硫酸鋅)溶液中,將Cu(銅)置於Cuso4(硫酸銅)溶液中,並用鹽橋或離子膜等方法將兩電解質溶液連線的一種原電池。...
