基本介紹
- 中文名:鉍化氫
- 外文名:Hydrogen Bismide
- 分子式:BiH3
- 別稱:䏟
- 物理性質:幾乎不溶於水,水溶液鹼性極弱
化學性質,主要用途,製備方法,
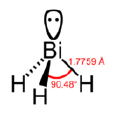
化學性質
2 BiH3 → 3 H2 + 2 Bi (ΔHf'gas = −278 kJ/mol)
主要用途
如過用強還原劑(比如鋅)在稀酸(不包括硝酸)的存在下,可將+3價的鉍化合物還原成鉍化氫(對砷和銻也可如此處理),在加熱到一定溫度時鉍化氫就分解為單質鉍與氫氣(砷化氫,銻化氫亦然),得到亮棕色的"鉍鏡",即可檢驗出鉍的存在。這是分析化學上檢驗鉍非常靈敏的方法---馬希法:
Bi2O3+6Zn+6H2SO4=====2BiH3+6ZnSO4+3H2O
2BiH3======2Bi+3H2
BiH3的還原性很強,可以從AgNO3中還原出銀,從CuSO4中還原出銅.因此可用這兩種溶液吸收鉍化氫氣體。
利用高純BiH3與金屬有機化合物加熱,可製備許多低雜質合金,如:
In(CH3)3+BiH3===加熱===InBi+3CH4
製備方法
BiH3 可由甲基鉍 BiH2Me 重新分配原子而成:
3BiH2CH3 → 2BiH3+BiMe3
而反應物甲基鉍本身也不穩定,是由Li[AlH4]還原BiCl2CH3而產生:
2BiCl2CH3+Li[AlH4]====2BiH2CH3+Li[AlCl4]