狹義的金屬氧化指金屬與氧化合成為氧化物的過程,即。廣義的金屬氧化指金屬失去電子從而正原子價升高的過程,即Μ=+e。金屬的氧化能否發生,取決於熱力學條件(見還原-氧化反應、氧勢圖)。
正文
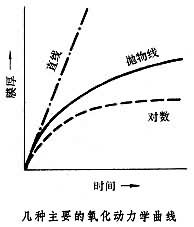
金屬的氧化膜 金屬氧化在金屬表面生成的覆蓋物,稱為氧化膜。在金屬氧化的初始階段,膜的增厚與時間常呈線性關係。達一定程度後,膜如果有裂紋,或疏鬆多孔,則無保護性,金屬的氧化繼續進行,膜的增厚曲線保持原來的直線形;膜如果比較緻密,具有一定的保護性,氧化受到阻滯,膜的增厚曲線轉為拋物線形;膜如果非常緻密,便具有良好的保護性,氧化基本停止,膜的增厚曲線轉為對數曲線形(見圖)。在溫度升高的情況下,化學反應以及金屬和氧通過膜的擴散均將加速,氧化也就會加速。鈀、銀、汞等金屬的氧化物由於熱力學上的不穩定,在高溫下會分解。環境氣氛中含有水蒸氣或硫化物時,導致加速氧化,尤以硫化物為嚴重,常稱這種情況為硫化腐蝕。
金屬的氧化和熱腐蝕完整的氧化膜才能保護金屬,因此,膜的體積()必須大於氧化消耗掉的金屬的體積(),這一規律稱為皮林-貝德沃斯(Pilling-Bedworth)定律,/的比值稱為皮林-貝德沃斯比。比值大於1的金屬(如Cr、Al、Si、Ti等),氧化膜的增厚曲線為拋物線或對數曲線形;比值小於1的金屬(如Ca、Μg、Na、K等),氧化膜的增厚曲線為直線。比值大於 1是能夠形成完整而有保護性氧化膜的必要條件而非充分條件。比值遠大於1時,膜中存在的應力會導致膜的開裂而失去完整性,也就不能起保護作用。
絕大多數的金屬氧化物是非化學計量關係的化合物。有許多是金屬離子不足的(點陣中有陽離子空位,如CuO,NiO),也有一些是金屬離子過剩的(點陣中有間隙金屬離子或陰離子空位,如ZnO),前者稱為p型,後者稱為n 型。膜的點陣中存在缺陷有利於金屬和氧通過膜進行擴散,因而有利於氧化的進行。一般說來,當氧的分壓增高時,p型的電導率和氧化速度增加,而n型的電導率和氧化速度減小。
合金的氧化 目前根據合金的成分還難以定量地推測它的氧化行為。但從熱力學觀點來看,氧化物的吉氏自由能更負的合金元素會先氧化。
如果在合金中氧的擴散比合金元素的擴散快,則合金中可能生成顆粒狀氧化物,這種現象稱為內氧化;晶界的氧化也屬於內氧化範疇。
如果合金基本元素的氧化物為p型,加入少量原子價較低的合金元素常能阻滯氧化,而加入少量原子價較高的元素常能加速氧化;如這種氧化物為n型,則效果正好相反。這一規律稱為豪費(Hauffe)定律。
熱腐蝕 在高溫和熔融的沉積物下,氧和其他腐蝕性氣體同時作用,產生的腐蝕稱為熱腐蝕。例如高溫合金在高溫含硫和鹽的燃氣中所發生的腐蝕。在這種情況下,金屬腐蝕生成的硫化膜疏鬆多孔或有裂紋,硫化物的晶體缺陷濃度較大,有利於金屬、氧和硫通過膜進行擴散,而且金屬硫化物的熔點較低,容易生成熔點更低的金屬-金屬硫化物共晶 (例如NiS熔點為 787℃,而Ni-NiS共晶熔點只有645℃),基於上述原因,熱腐蝕常比單純的高溫氧化嚴重得多。如果氣氛中含有釩、鉬等元素,由於VO的熔點僅674℃,MoO在高溫下易於揮發,會造成“災害性”高溫腐蝕。
防止措施 主要有:①調整合金成分。目的是形成緻密氧化膜,提高合金的抗氧化能力。加入的合金元素的皮林-貝德沃斯比值(/)應大於1。合金元素的吉氏自由能應較基體金屬為負,能先氧化。合金元素應根據豪費定律選擇。為了提高抗熱腐蝕能力,常加入的合金元素通常為鉻、鋁、鈦和稀土,其中鉻和少量稀土的作用已得到公認,對於鋁和鈦的作用還有爭議。②外加保護層。採用滲鋁、滲鉻、滲矽或鉻-鋁、鋁-矽等多元共滲等化學熱處理工藝,使工件的表層合金化;或濺射、熔焊、包鍍耐蝕合金,形成耐蝕表面。新發展起來的覆護層Μ-Cr-Al-Y合金對表面保護尤為有效。此外,為提高抗熱腐蝕能力也有採用高溫陶瓷塗層的。③改變環境介質條件。如採用控制氣氛以防止氧化,進行燃料脫鹽和脫硫等措施防止熱腐蝕。
 金屬的氧化和熱腐蝕
金屬的氧化和熱腐蝕
