重組人血小板生成素注射液,適應症為1.本品適用於治療實體瘤化療後所致的血小板減少症,適用對象為血小板低於50×109/L且醫生認為有必要升高血小板治療的患者。2.本品用於特發性血小板減少性紫癜(ITP)的輔助治療,適用對象為血小板低於20×109/L的糖皮質激素治療無效(包括初始治療無效、或有效後復發而再度治療無效的未接受脾切除治療的患者。本品僅用於血小板減少及臨床狀態具有增加出血風險的患者,不套用於試圖使血小板計數升至正常數值的目的。
基本介紹
- 藥品名稱:重組人血小板生成素注射液
- 藥品類型:處方藥、工傷用藥
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,臨床試驗,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,
成份
重組人血小板生成素(由含有高效表達人血小板生成素基因的中國倉鼠卵巢(CHO)細胞,經細胞培養、分離和高度純化後製成)。
輔料為:人血白蛋白、氯化鈉。
輔料為:人血白蛋白、氯化鈉。
性狀
本品為無色澄明液體,無肉眼可見不溶物。
適應症
1.本品適用於治療實體瘤化療後所致的血小板減少症,適用對象為血小板低於50×109/L且醫生認為有必要升高血小板治療的患者。
2.本品用於特發性血小板減少性紫癜(ITP)的輔助治療,適用對象為血小板低於20×109/L的糖皮質激素治療無效(包括初始治療無效、或有效後復發而再度治療無效的未接受脾切除治療的患者。本品僅用於血小板減少及臨床狀態具有增加出血風險的患者,不套用於試圖使血小板計數升至正常數值的目的。
2.本品用於特發性血小板減少性紫癜(ITP)的輔助治療,適用對象為血小板低於20×109/L的糖皮質激素治療無效(包括初始治療無效、或有效後復發而再度治療無效的未接受脾切除治療的患者。本品僅用於血小板減少及臨床狀態具有增加出血風險的患者,不套用於試圖使血小板計數升至正常數值的目的。
規格
每瓶裝量1.0ml。
7500單位/1毫升(7500U/1ml),
15000單位/1毫升(15000U/1ml)。
7500單位/1毫升(7500U/1ml),
15000單位/1毫升(15000U/1ml)。
用法用量
本品應在臨床醫師指導下使用。具體用法、劑量和療程因病而異,推薦劑量和方法如下:
1.惡性實體腫瘤化療時,預計藥物劑量可能引起血小板減少及誘發出血且需要升高小板時,可於給藥結束後6 ~24小時皮下注射本品,劑量為每日每公斤體重300U,每日一次,連續套用14天;用藥過程中待血小板計數恢復至100×109/L以上,或血小板計數絕對值升高≥50×109/L時即應停用。當化療中伴發白細胞嚴重減少或出現貧血時,本品可分別與重組人粒細胞集落刺激因子(rhG-CSF)或重組人紅細胞生成素(rhEPO)合併使用。
2.糖皮質激素治療無效的特發性血小板減少性紫癜(ITP)(參見【臨床試驗】項下相關內容)
糖皮質激素治療無效(包括上述適應症第2條中所涵蓋的範圍)時,可皮下注射本品,劑量為每日每公斤體重300U,每日一次,連續套用14天;若不足14天血小板計數已經升至≥100×109/L時則停止使用本品。若出現口、鼻或內臟等部位出血時,可給予輸注血小板、抗纖溶止血藥等應急處理。
1.惡性實體腫瘤化療時,預計藥物劑量可能引起血小板減少及誘發出血且需要升高小板時,可於給藥結束後6 ~24小時皮下注射本品,劑量為每日每公斤體重300U,每日一次,連續套用14天;用藥過程中待血小板計數恢復至100×109/L以上,或血小板計數絕對值升高≥50×109/L時即應停用。當化療中伴發白細胞嚴重減少或出現貧血時,本品可分別與重組人粒細胞集落刺激因子(rhG-CSF)或重組人紅細胞生成素(rhEPO)合併使用。
2.糖皮質激素治療無效的特發性血小板減少性紫癜(ITP)(參見【臨床試驗】項下相關內容)
糖皮質激素治療無效(包括上述適應症第2條中所涵蓋的範圍)時,可皮下注射本品,劑量為每日每公斤體重300U,每日一次,連續套用14天;若不足14天血小板計數已經升至≥100×109/L時則停止使用本品。若出現口、鼻或內臟等部位出血時,可給予輸注血小板、抗纖溶止血藥等應急處理。
不良反應
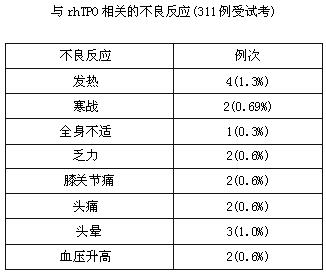
1.較少發生不良反應,偶有發熱、肌肉酸痛、頭暈等,一般不需處理,多可自行成恢復。個別患者症狀明顯可對症處理。本品在III期臨床試驗中未見嚴重不良反應。在311例受試者中有12例(3.86%)共18例次出現與rhTPO用藥有關的輕微不良反應,其中發熱4例,寒戰2例,全身不適1列,乏力2例,膝關節痛2例,頭痛2例,頭暈3例,血壓升高2例,症狀大多輕微,無需特殊處理。實驗室檢查rhTPO對化療後血紅蛋白和白細胞計數的恢復無影響,對血小板形態、血小板聚集功能、凝血功能、肝腎等臟器功能無顯著影響。74例患者在治療周期接受了抗體動態檢測,3例患者(4%)於給藥後第21天和第28天的血清中檢測低滴度(1:5)非中和性抗rhTPO抗體,未發現對rhTPO升高血小板的作用造成影響。
與rhTPO相關的不良反應(311例受試考)
與rhTPO相關的不良反應(311例受試考)
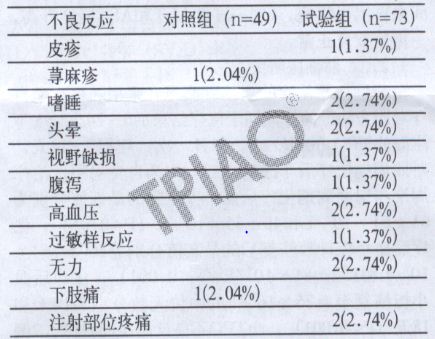
2.糖皮質激素治療無效的ITP臨床研究中與rhTPO相關不良反應
在多中心、隨機對照試驗中(該實驗共分兩個階段:第一階段治療14天,實驗組給予rhTPO+達那唑,對照組給予達那唑;第二階段實驗組治療檔案不變;對照組中血小板計數仍≤20×109/L著加用rhTPO治療)共有138例受試者納入安全性分析集(試驗組73例,對照組65例),試驗期間試驗組和對照組的不良事件發生率分別為34.25%和26.15%。兩個階段共有122例受試者接受rhTPO治療(試驗組73例,對照組49例),其中不良事件導致脫落者共4例,對照組2例次(肝功能異常和口腔出血各1例次);試驗組2例次(用藥9天II度顱內出血各1例次,用藥1天IV度顱內出血1例次),試驗組有1例出血死亡病例。
兩研究組接受rhTPO治療的122例受試者中與rhTPO治療的122例受試者中與rhTPO治療相關的不良事件的發生率分別為15.07%和4.08%。試驗相關不良事件表現為輕度嗜睡2例次、輕度頭暈2例次。重度陣發性視野破損1例次、輕度過敏樣反應1例次、輕度皮疹1例次、輕度無力2例次、輕度腹瀉1例次。輕度高血壓2例次及注射部位疼痛2例次;對照組相關不良事件表現為中度蕁麻疹和輕度下肢痛各1例次。rhTPO對血紅蛋白、白細胞計數、凝血功能的變化無明顯影響。糖皮質激素治療無效ITP的臨床研究中rhTPO相關不良反應(例次/%)
禁忌
1、對本品成份過敏者;
2、嚴重心、腦血管疾病者;
3、患有其它血液高凝狀疾病者,近期發生血栓病者;
4、合併嚴重感染者,宜控制感染後再使用本品。
2、嚴重心、腦血管疾病者;
3、患有其它血液高凝狀疾病者,近期發生血栓病者;
4、合併嚴重感染者,宜控制感染後再使用本品。
注意事項
1、本品過量套用或常規套用於特異體質者可造成血小板過度升高,必須在三甲醫院並在有經驗的臨床醫師指導下使用;
2、本品治療實體瘤化療後所致的血小板減少症適用對象為血小板低於50*109/L且醫生認為有必要升高血小板治療的患者;
本品治療糖皮質激素治療無效的特發性血小板減少性紫癜(ITP)適用對象為血小板低於20*109/L或醫生認為有必要升高血小板治療的患者;即使套用本品治療,病人也應繼續避免可能增加出血風險的狀況或者藥物的套用。
3、本品應體瘤化療後所致的血小板減少症應在化療結束後6-24小時開始使用;
4、骨髓網硬蛋白形成或骨髓纖維化風險;文獻報導,國外同類製劑(Nplate)可增加骨髓區域網路狀纖維沉積出現或加重的風險。臨床研究也並未排除骨髓纖維化伴隨細胞減少症出現的風險,套用本品前對外周血塗片進行仔細檢查以建立細胞形態異常的基線水平。套用過程中建議定期檢查外周血塗片和血常規,以便發現新的細胞形態異常或原有的細胞形態異常加重(如淚滴形和有核紅細胞、幼稚白細胞或白細胞減少)。如果病人出現上述情況,應終止本品治療並考慮進行骨髓穿刺,包括纖維染色。
5、停藥後血小板減少症的惡化;國外同類製劑文獻報導,停藥後可能會發生比治療前更嚴重的血小板減少症。血小板減少症惡化會增加病人出血的風險,特別是在病人在套用抗凝及抗血小板藥物治療過程中的停藥。這種血小板減少症惡化可在14天內緩解。建議停藥後每周進行一次包括血小板計數在內的血常規檢查至少兩周,並針對惡化後的血小板減少症根據現行治療指南考慮修訂治療方案。
6、並發血栓形成/血栓栓子:血小板計數的過度升高可能會導致並發血栓形成/血栓性栓子。過量或錯誤使用本品可能會使血小板計數升高到可導致並發血栓形成/血栓栓子的水平。為了使發生血栓形成/血栓栓子的風險降到最低,在套用本品時不應試圖是血小板計數達到正常值。
7、對底反應性或不能維持血小板應答者應進一步查找誘發因素,包括本品的中和抗體或者骨髓纖維化。如果血小板計數不能升高到足矣避免臨床重症出血的水平,請停藥。對本品臨床研究中的74名患者(包括ITP患者和腫瘤患者)的檢查結果顯示3例(4%,3/74)出現1:5滴度的抗TPO抗體,無中和作用。
8、惡性腫瘤和惡性腫瘤惡化:本品對造血細胞表面的TPO受體的刺激可能會增加惡性血液病的發生風險。除治療糖皮質激素治療無效的特發性血小板減少性紫癜(ITP)外,本品不用於治療脊髓發育不良綜合徵(MDS)或者其他原因引起的血小板減少症。
9、使用本品過程中應定期檢查血常規,一般應隔日一次,密切注意外周血小板計數的變化,血小板計數達到所需指標時,應及時停藥。在用藥之前,用藥過程中以及用藥之後的隨訪中監測包括血小板計數(外周血塗片)在內的血常規。在套用本品檢查外周血分類,建立紅細胞和白細胞異常形態的基線水平。定期檢查血常規,包括血小板計數
4、使用本品過程中應定期檢查血常規,一般應隔日一次,密切注意外周血小板計數的變化,血小板計數達到所需指標時,應及時停藥。停藥後定期監測至少兩周。
2、本品治療實體瘤化療後所致的血小板減少症適用對象為血小板低於50*109/L且醫生認為有必要升高血小板治療的患者;
本品治療糖皮質激素治療無效的特發性血小板減少性紫癜(ITP)適用對象為血小板低於20*109/L或醫生認為有必要升高血小板治療的患者;即使套用本品治療,病人也應繼續避免可能增加出血風險的狀況或者藥物的套用。
3、本品應體瘤化療後所致的血小板減少症應在化療結束後6-24小時開始使用;
4、骨髓網硬蛋白形成或骨髓纖維化風險;文獻報導,國外同類製劑(Nplate)可增加骨髓區域網路狀纖維沉積出現或加重的風險。臨床研究也並未排除骨髓纖維化伴隨細胞減少症出現的風險,套用本品前對外周血塗片進行仔細檢查以建立細胞形態異常的基線水平。套用過程中建議定期檢查外周血塗片和血常規,以便發現新的細胞形態異常或原有的細胞形態異常加重(如淚滴形和有核紅細胞、幼稚白細胞或白細胞減少)。如果病人出現上述情況,應終止本品治療並考慮進行骨髓穿刺,包括纖維染色。
5、停藥後血小板減少症的惡化;國外同類製劑文獻報導,停藥後可能會發生比治療前更嚴重的血小板減少症。血小板減少症惡化會增加病人出血的風險,特別是在病人在套用抗凝及抗血小板藥物治療過程中的停藥。這種血小板減少症惡化可在14天內緩解。建議停藥後每周進行一次包括血小板計數在內的血常規檢查至少兩周,並針對惡化後的血小板減少症根據現行治療指南考慮修訂治療方案。
6、並發血栓形成/血栓栓子:血小板計數的過度升高可能會導致並發血栓形成/血栓性栓子。過量或錯誤使用本品可能會使血小板計數升高到可導致並發血栓形成/血栓栓子的水平。為了使發生血栓形成/血栓栓子的風險降到最低,在套用本品時不應試圖是血小板計數達到正常值。
7、對底反應性或不能維持血小板應答者應進一步查找誘發因素,包括本品的中和抗體或者骨髓纖維化。如果血小板計數不能升高到足矣避免臨床重症出血的水平,請停藥。對本品臨床研究中的74名患者(包括ITP患者和腫瘤患者)的檢查結果顯示3例(4%,3/74)出現1:5滴度的抗TPO抗體,無中和作用。
8、惡性腫瘤和惡性腫瘤惡化:本品對造血細胞表面的TPO受體的刺激可能會增加惡性血液病的發生風險。除治療糖皮質激素治療無效的特發性血小板減少性紫癜(ITP)外,本品不用於治療脊髓發育不良綜合徵(MDS)或者其他原因引起的血小板減少症。
9、使用本品過程中應定期檢查血常規,一般應隔日一次,密切注意外周血小板計數的變化,血小板計數達到所需指標時,應及時停藥。在用藥之前,用藥過程中以及用藥之後的隨訪中監測包括血小板計數(外周血塗片)在內的血常規。在套用本品檢查外周血分類,建立紅細胞和白細胞異常形態的基線水平。定期檢查血常規,包括血小板計數
4、使用本品過程中應定期檢查血常規,一般應隔日一次,密切注意外周血小板計數的變化,血小板計數達到所需指標時,應及時停藥。停藥後定期監測至少兩周。
孕婦及哺乳期婦女用藥
對孕婦及哺乳期婦女的用藥安全性尚未確立,故原則上不宜套用。
兒童用藥
尚不清楚。
老年用藥
尚不清楚。
藥物相互作用
尚不清楚。
藥物過量
據國外文獻報導,過量使用本品可使血小板計數過度增加而導致並發血栓形成/血栓栓子。此種情況下,停用本品並檢測血小板計數。
臨床試驗
1、I期臨床研究
I期27例正常人接受單次皮下注射給藥耐受試驗,給藥劑量分別為75U/kg、150U/kg、300U/kg和600U/kg 4組,每組例數分別為3、6、9、9。單次皮下注射rhTPO有劑量依賴性升血小板作用,在150U/kg~600U/kg劑量下,平均比給藥前升高24% ~52%,個別受試者升高100%。血小板計數於給藥後第10 ~14天升至高峰,給藥後21天時基本回落至給藥前水平。1例出現一過性低熱和乏力,1例出現嗜睡,均自然消退。1例一過性ALT和AST輕度升高,一周后恢復正常。I期7例血液腫瘤患者接受連續皮下注射給藥耐受試驗,給藥劑量為每次300U/kg,每日一次,連續7~14天。受試者的血小板計數出現不同程度升高,約在開始給藥的第14 ~28天達到高峰。1例受試者於給藥的第7天出現右脛骨疼痛,對症處理兩天后疼痛緩解,後續給藥期間未再出現疼痛,1例一過性ALT和AST輕度升高,一周后恢復正常。
2、II期臨床研究
62例接受化療的實體腫瘤患者採用隨機交叉自身對照方法,治療周期於化療結束後6 ~24小時皮下注射rhTPO 300U/kg,每日一次,療程7~14天,對照周期化療後不注射rhTPO作為自身對照。治療周期與對照周期化療後血小板下降的最低值分別為61±51×109/L和48±35×109/L (P<0.05),化療後血小板計數恢復後的最高值分別為260±164×109/L和152±81×109/L (P<0.001),化療後血小板恢復至≥75×109/L的中位天數分別為14天和18天(P<0.001)。rhTPO不良反應少而輕微,2例患者出現與rhTPO相關的不良反應,表現為用藥後發熱,最高可達38.8℃,可自然消退或結束用藥後體溫恢復正常。rhTPO對化療後血紅蛋白、紅細胞計數和白細胞計數的恢復無影響,對血小板形狀、血小板聚集功能和肝腎等臟器的功能無顯著影響。7例患者在用藥周期接受了抗rhTPO抗體動態檢測,1例患者在rhTPO給藥起第14天血清中測出低滴度(1:5)抗體,未發現對rhTPO升高血小板的作用造成影響。
3、III期臨床研究
在多中心III期臨床試驗的311例受試者中,92例接受化療後小板減少的實體腫瘤患者採用隨機交叉自身對照方法,治療周期於化療結束後6 ~24小時皮下注射rhTPO 300U/kg,每日一次,療程7~14天,對照周期化療不注射rhTPO作為自身對照。治療周期與對照周期化療後血小板下降的最低值分別為66±41×109/L和55±27×109/L(P[0.001),化療後血小板計數恢復後的最高值分別為266±126×109/L和146±56×109/L(P<0.001),化療後血小板恢復至≥75×109/L的中位天數分別為11天和16天(P[0.001)。結果顯示,化療後血小板減少時,rhTPO能明顯升高血小板計數,減輕血小板下降的最低值,加快血小板計數的恢復。92例實體瘤患者中有42例對照周期化療後血小板明顯降低(低於50×109/L),對該組的統計結果顯示,用藥周期與對照周期化療後血小板下降的最低值中位數分別為50×109/L和32×109/L(P[0.001),化療後血小板計數恢復後的最高值中分別為204×109/L和114×109/L(P<0.001),化療後血小板低於50×109/L的中位數分別為1天和6天(P[0.001),III期臨床試驗中相關不良反應見【不良反應】。
I期27例正常人接受單次皮下注射給藥耐受試驗,給藥劑量分別為75U/kg、150U/kg、300U/kg和600U/kg 4組,每組例數分別為3、6、9、9。單次皮下注射rhTPO有劑量依賴性升血小板作用,在150U/kg~600U/kg劑量下,平均比給藥前升高24% ~52%,個別受試者升高100%。血小板計數於給藥後第10 ~14天升至高峰,給藥後21天時基本回落至給藥前水平。1例出現一過性低熱和乏力,1例出現嗜睡,均自然消退。1例一過性ALT和AST輕度升高,一周后恢復正常。I期7例血液腫瘤患者接受連續皮下注射給藥耐受試驗,給藥劑量為每次300U/kg,每日一次,連續7~14天。受試者的血小板計數出現不同程度升高,約在開始給藥的第14 ~28天達到高峰。1例受試者於給藥的第7天出現右脛骨疼痛,對症處理兩天后疼痛緩解,後續給藥期間未再出現疼痛,1例一過性ALT和AST輕度升高,一周后恢復正常。
2、II期臨床研究
62例接受化療的實體腫瘤患者採用隨機交叉自身對照方法,治療周期於化療結束後6 ~24小時皮下注射rhTPO 300U/kg,每日一次,療程7~14天,對照周期化療後不注射rhTPO作為自身對照。治療周期與對照周期化療後血小板下降的最低值分別為61±51×109/L和48±35×109/L (P<0.05),化療後血小板計數恢復後的最高值分別為260±164×109/L和152±81×109/L (P<0.001),化療後血小板恢復至≥75×109/L的中位天數分別為14天和18天(P<0.001)。rhTPO不良反應少而輕微,2例患者出現與rhTPO相關的不良反應,表現為用藥後發熱,最高可達38.8℃,可自然消退或結束用藥後體溫恢復正常。rhTPO對化療後血紅蛋白、紅細胞計數和白細胞計數的恢復無影響,對血小板形狀、血小板聚集功能和肝腎等臟器的功能無顯著影響。7例患者在用藥周期接受了抗rhTPO抗體動態檢測,1例患者在rhTPO給藥起第14天血清中測出低滴度(1:5)抗體,未發現對rhTPO升高血小板的作用造成影響。
3、III期臨床研究
在多中心III期臨床試驗的311例受試者中,92例接受化療後小板減少的實體腫瘤患者採用隨機交叉自身對照方法,治療周期於化療結束後6 ~24小時皮下注射rhTPO 300U/kg,每日一次,療程7~14天,對照周期化療不注射rhTPO作為自身對照。治療周期與對照周期化療後血小板下降的最低值分別為66±41×109/L和55±27×109/L(P[0.001),化療後血小板計數恢復後的最高值分別為266±126×109/L和146±56×109/L(P<0.001),化療後血小板恢復至≥75×109/L的中位天數分別為11天和16天(P[0.001)。結果顯示,化療後血小板減少時,rhTPO能明顯升高血小板計數,減輕血小板下降的最低值,加快血小板計數的恢復。92例實體瘤患者中有42例對照周期化療後血小板明顯降低(低於50×109/L),對該組的統計結果顯示,用藥周期與對照周期化療後血小板下降的最低值中位數分別為50×109/L和32×109/L(P[0.001),化療後血小板計數恢復後的最高值中分別為204×109/L和114×109/L(P<0.001),化療後血小板低於50×109/L的中位數分別為1天和6天(P[0.001),III期臨床試驗中相關不良反應見【不良反應】。

4、糖皮質激素治療無效的特發性血小板減少性紫癜(ITP)的臨床研究
在多中心、隨機開放、空白對照試驗共納入140例受試者,將糖皮質激素治療無效的患者(血小板計數≤20*109/L)按是否接受過脾切除進行分層隨機分組。該實驗共分兩個階段;前14天為第1階段,試驗組(rhTPO+達那唑)rhTPO 1.0ug/kg(300U/kg)皮下注射,每日1次,療程14天。對照組(達那唑)在第一階段治療後(試驗開始14天后)若血小板計數仍在≤20*109/L可在第二階段加用rhTPO治療,劑量和方法與試驗組相同。結果顯示,根據第二屆全國血液學術會議制定的ITP療效判斷標準中有效標準(即“顯效加有效,即血小板升至50*109/L以上或較原水平上升30*109/L,無或基本無出血症狀”),第一階段(試驗開始的14天內),試驗組rhTPO治療達顯效者(血小板升至100*109/L)占38.36%,明顯高於對照組的7.94%(P=0.0002)。試驗組達良效者(血小板升至50*109/L或較原水平上升30*109/L)為21.92%,與對照組(28.57%)相當。試驗組近期有效率(顯效+良效)達到60.27%,明顯高於對照組的36.51%(P=0.0104)
其他指標顯示,試驗組血小板計數的最高值為113.73±155.26(*109/L),升高值(最高值-基線值)為101.23±155.81(*109/L),均顯著高於對照組的43.78±55.67(*10[sup]9[/sup]/L)和33.31±55.54(*109/L)(p=0.0000)。試驗組25%患者達到有效的時間為7天,對照組為10天。
亞組分析顯示:未接受脾切除受試者(FAS集64.55)試驗組有效率為57.81%,對照組為32.37%,兩組間差異顯著,接受脾切除受試者(FAS集8:9)因例數較少無法評價。對於極限小於10*10[sup]9[/sup]/L的受試者,試驗組有效率(FAS)為54.05%(20/37),對照組為41.67%(5/12)。差異均無統計學意義。
臨床試驗中rhTPO相關不良反應請參見【不良反應】部分。
藥理毒理
1、藥理
血小板生成素(thrombopoietin,TPO)是刺激巨核細胞生長及分化的內源性細胞因子,對巨核細胞生成的各階段均有刺激作用,包括前體細胞的增殖和多倍體巨核細胞的發育及成熟,從而升高血小板數目。重組人血小板生成素(rhTPO)是利用基因重組技術由中國倉鼠卵巢細胞表達,經提純製成的全長糖基化血小板生成素,與內源性血小板生成素具有相似的升高血小板的藥理作用。
一次大劑量60Co g射線全身照射獼猴造成骨髓抑制模型後,分別皮下注射rhTPO 150U/Kg、600 U/Kg和人血白蛋白20mg/ Kg,每日一次,連續給藥20天。實驗結果顯示,rhTPO使低谷期的血小板計數平均值升高,處於低值的時間縮短,並使骨髓抑制低谷期的外周血小板聚集率升高。其最低有效劑量為每日150 U/Kg。
Balb/c系小鼠腹腔注射卡鉑150mg/kg造成血小板減少模型,經腹腔分別給予rhTPO1.1×102U、1.1×103U、1.1×104U/kg及生理鹽水,每日一次,連續給藥rhTPO 1.1×103U/kg以上各劑量組能明顯減緩卡鉑所致血小板數下降。
具有巨核細胞抗原表達的HEL和DAMI細胞系及正常人骨髓細胞的體外培養體系中,加入rhTPO能特異地提高巨核細胞系和正常人骨髓單個核細胞CD41抗原的表達,並且促進巨核細胞集落(CFU-Meg)形成。
2、毒理
(1)急性毒性:rhTPO1.35×105U/kg和2.25×105U/kg(相當於臨床推薦給藥劑量的900和1500倍)分別給予大鼠和小鼠尾靜脈緩慢注射,給藥後即刻及14天內動物未出現毒性反應或死亡。內臟病理組織學檢查未見異常。此外,給大鼠和小鼠背部皮下注射rhTPO1.8×105U/kg和4.5×105U/kg(相當臨床推薦劑量1200和3000倍),給藥後動物無明顯毒性反應。觀察14天動物未出現毒性反應和死亡。病理組織學檢查各主要臟器未見異常。
(2)慢性毒性:Wistar系大鼠經皮下注射rhTPO連續35天,劑量為1.5×104U/kg、7.5×103U/kg和1.5×103U/kg(分別相當臨床推薦用藥劑量的100倍、50倍和10倍),兩組對照組分別注射0.5%人血白蛋白和生理鹽水。大鼠的一般狀況、飼料的利用率、白細胞分類、凝血時間、尿常規及病理組織學檢查結果表明,rhTPO各組與對照組在不同時間點均無顯著性差別。給藥三周后,末梢血小板總數隨給藥周數增加持續顯著下降,且劑量高組下降更顯著。停藥後高、中劑量組骨髓巨核系恢復緩慢。說明高、中劑量組給藥兩周后產生明顯蓄積毒性。低劑量組給藥四周時產生蓄積毒性,但停藥兩周能明顯恢復至給藥前水平,且骨髓巨核系也明顯恢復正常。rhTPO 1.5×103U/kg應視為大鼠皮下給藥無明顯毒副作用的劑量。
24隻獼候皮下分別注射rhTPO 9×102U/kg、1.8×103U/kg、5.4×103U/kg(分別相當臨床推薦用藥劑量的6倍、12倍、36倍)、0.5%人血白蛋白、生理鹽水,給藥30天至停藥28天觀察結果表明,雌雄獼候一般狀況、食慾、體重、體溫、血清十項生化和尿十項檢測、 心電圖和病理組織學檢查在各組中無明顯差別。其中中、高劑量給藥30天引起獼猴由給藥早期末梢血小板總數急劇增加至給藥後血小板總數急劇減少,且血小板總數恢復緩慢。表明大劑量、長時間連續給藥在促進血小板急劇生成後,引起獼候巨核系生成血小板障礙。低劑量組連續給藥30天對獼猴沒有產生明顯蓄積毒性。rhTPO 9×102U/kg應視為對獼候無明顯毒副作用的劑量。
(3)致突變毒性:rhTPO對NIH系小鼠骨髓多染紅細胞無誘發微核率升高的作用。rhTPO 3×103U、1.5×103U、7.5×102U、3.8×102U、1.9×102U 5個劑量組均不誘發鼠傷寒沙門氏菌基因突變。rhTPO在2.4×104U/ml劑量下對人二倍體細胞沒有致染色體畸變作用。本品在常規微核試驗、Ames試驗和染色體試驗的結果均為陰性。
血小板生成素(thrombopoietin,TPO)是刺激巨核細胞生長及分化的內源性細胞因子,對巨核細胞生成的各階段均有刺激作用,包括前體細胞的增殖和多倍體巨核細胞的發育及成熟,從而升高血小板數目。重組人血小板生成素(rhTPO)是利用基因重組技術由中國倉鼠卵巢細胞表達,經提純製成的全長糖基化血小板生成素,與內源性血小板生成素具有相似的升高血小板的藥理作用。
一次大劑量60Co g射線全身照射獼猴造成骨髓抑制模型後,分別皮下注射rhTPO 150U/Kg、600 U/Kg和人血白蛋白20mg/ Kg,每日一次,連續給藥20天。實驗結果顯示,rhTPO使低谷期的血小板計數平均值升高,處於低值的時間縮短,並使骨髓抑制低谷期的外周血小板聚集率升高。其最低有效劑量為每日150 U/Kg。
Balb/c系小鼠腹腔注射卡鉑150mg/kg造成血小板減少模型,經腹腔分別給予rhTPO1.1×102U、1.1×103U、1.1×104U/kg及生理鹽水,每日一次,連續給藥rhTPO 1.1×103U/kg以上各劑量組能明顯減緩卡鉑所致血小板數下降。
具有巨核細胞抗原表達的HEL和DAMI細胞系及正常人骨髓細胞的體外培養體系中,加入rhTPO能特異地提高巨核細胞系和正常人骨髓單個核細胞CD41抗原的表達,並且促進巨核細胞集落(CFU-Meg)形成。
2、毒理
(1)急性毒性:rhTPO1.35×105U/kg和2.25×105U/kg(相當於臨床推薦給藥劑量的900和1500倍)分別給予大鼠和小鼠尾靜脈緩慢注射,給藥後即刻及14天內動物未出現毒性反應或死亡。內臟病理組織學檢查未見異常。此外,給大鼠和小鼠背部皮下注射rhTPO1.8×105U/kg和4.5×105U/kg(相當臨床推薦劑量1200和3000倍),給藥後動物無明顯毒性反應。觀察14天動物未出現毒性反應和死亡。病理組織學檢查各主要臟器未見異常。
(2)慢性毒性:Wistar系大鼠經皮下注射rhTPO連續35天,劑量為1.5×104U/kg、7.5×103U/kg和1.5×103U/kg(分別相當臨床推薦用藥劑量的100倍、50倍和10倍),兩組對照組分別注射0.5%人血白蛋白和生理鹽水。大鼠的一般狀況、飼料的利用率、白細胞分類、凝血時間、尿常規及病理組織學檢查結果表明,rhTPO各組與對照組在不同時間點均無顯著性差別。給藥三周后,末梢血小板總數隨給藥周數增加持續顯著下降,且劑量高組下降更顯著。停藥後高、中劑量組骨髓巨核系恢復緩慢。說明高、中劑量組給藥兩周后產生明顯蓄積毒性。低劑量組給藥四周時產生蓄積毒性,但停藥兩周能明顯恢復至給藥前水平,且骨髓巨核系也明顯恢復正常。rhTPO 1.5×103U/kg應視為大鼠皮下給藥無明顯毒副作用的劑量。
24隻獼候皮下分別注射rhTPO 9×102U/kg、1.8×103U/kg、5.4×103U/kg(分別相當臨床推薦用藥劑量的6倍、12倍、36倍)、0.5%人血白蛋白、生理鹽水,給藥30天至停藥28天觀察結果表明,雌雄獼候一般狀況、食慾、體重、體溫、血清十項生化和尿十項檢測、 心電圖和病理組織學檢查在各組中無明顯差別。其中中、高劑量給藥30天引起獼猴由給藥早期末梢血小板總數急劇增加至給藥後血小板總數急劇減少,且血小板總數恢復緩慢。表明大劑量、長時間連續給藥在促進血小板急劇生成後,引起獼候巨核系生成血小板障礙。低劑量組連續給藥30天對獼猴沒有產生明顯蓄積毒性。rhTPO 9×102U/kg應視為對獼候無明顯毒副作用的劑量。
(3)致突變毒性:rhTPO對NIH系小鼠骨髓多染紅細胞無誘發微核率升高的作用。rhTPO 3×103U、1.5×103U、7.5×102U、3.8×102U、1.9×102U 5個劑量組均不誘發鼠傷寒沙門氏菌基因突變。rhTPO在2.4×104U/ml劑量下對人二倍體細胞沒有致染色體畸變作用。本品在常規微核試驗、Ames試驗和染色體試驗的結果均為陰性。
藥代動力學
正常人單次皮下注射rhTPO藥代動力學研究:受試者隨機分為150U/kg、300U/kg、600U/kg三個劑量組,每組8例,共24例,結果顯示在體內的吸收與消除過程基本符合線性動力學特徵,三個劑量組的T1/2Ka分別為2.5±1.1h、3.2±2.6h和4.2±2.4h,Tmax分別為9.0±1.9h、10.8±2.4h和11.8±5.4h。rhTPO消除比較緩慢,體內半衰期較長。三個劑量組消除半衰期相近,分別為46.3±6.9h、40.2±9.4h和38.7±11.9h。
多次皮下注射rhTPO藥代動力學研究:8名患者分為隔日給藥組(隔日皮下注射rhTPO 1.0mg/kg,相當於300U/kg,共7次)和每日給藥組(每日皮下注射rhTPO1.0mg/kg,相當於300U/kg,共14次)兩組,每組4例。隨給藥次數的增加,每個受試者的血藥濃度隨之升高,隔日給藥組和每日給藥組的谷濃度(Cmin)分別在5次和7次給藥後達到穩態水平,穩態Cmin分別為1637±969pg/ml和2096±1736pg/ml。兩組的峰濃度(Cmax)的變化趨勢與谷濃度相似,穩態峰Cmax分別為2135±1095pg/ml和4193±3436pg/ml。每個受試者第1次給藥後的AUC以及Tpeak和t1/2等藥代動力學參數與末次給藥後相比無明顯差異,即無時間依賴性的藥代動力學變化。多次皮下注射rhTPO,血藥濃度升高的水平與給藥的累積劑量正相關,在給藥14次內,藥物在體內無蓄積傾向。
多次皮下注射rhTPO藥代動力學研究:8名患者分為隔日給藥組(隔日皮下注射rhTPO 1.0mg/kg,相當於300U/kg,共7次)和每日給藥組(每日皮下注射rhTPO1.0mg/kg,相當於300U/kg,共14次)兩組,每組4例。隨給藥次數的增加,每個受試者的血藥濃度隨之升高,隔日給藥組和每日給藥組的谷濃度(Cmin)分別在5次和7次給藥後達到穩態水平,穩態Cmin分別為1637±969pg/ml和2096±1736pg/ml。兩組的峰濃度(Cmax)的變化趨勢與谷濃度相似,穩態峰Cmax分別為2135±1095pg/ml和4193±3436pg/ml。每個受試者第1次給藥後的AUC以及Tpeak和t1/2等藥代動力學參數與末次給藥後相比無明顯差異,即無時間依賴性的藥代動力學變化。多次皮下注射rhTPO,血藥濃度升高的水平與給藥的累積劑量正相關,在給藥14次內,藥物在體內無蓄積傾向。
貯藏
2~8℃,避光保存和運輸。
包裝
1瓶,西林瓶裝。
有效期
36個月
執行標準
WS4-(S-024)-2010Z
