基本介紹
逸度因子定義,逸度因子特點及套用,實際用例,
逸度因子定義
逸度因子特點及套用
真實氣體和理想氣體P*-p關係及氣體的標準態見圖3-5。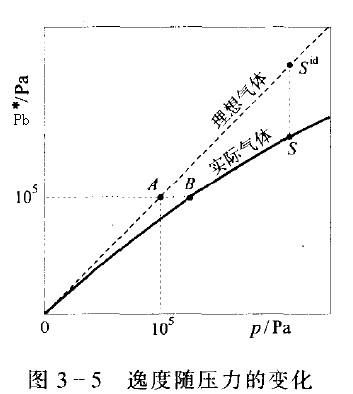 逸度隨壓力的變化
逸度隨壓力的變化
 逸度隨壓力的變化
逸度隨壓力的變化從圖中可以看出:理想氣體的P*-p線為通過原點斜率為1的一條直線,在任意壓力下均有P*=p;真實氣體的P*=p線在原點處與理想氣體重合,隨著壓力增大,曲線偏離理想氣體的直線,圖中繪出在常壓下P*<p的真實氣體示意圖曲線。氣體的標準態按規定為在溫度T下、壓力為p^的理想氣體,即圖中A點。真實氣體P*=p^的B點,雖然其化學勢在數值上等於μ*,但不是標準態。因為標準態的規定涉及摩爾焓、摩爾熵、摩爾吉布斯函式等一系列熱力學數值的規定,因此要注意標準態與P*=p^狀態區別。
實際用例
例如,標準態時氣體的摩爾焓等於相同溫度零壓力下真實氣體的摩爾焓,標準摩爾熵為相同溫度P=p^下具有理想氣體性質的摩爾熵。但圖3-5中B點的摩爾焓不同於零壓下的摩爾焓,摩爾熵也不等於標準摩爾熵,顯然B點不是氣體的標準態。
