基本介紹
- 中文名:逸度
- 外文名:Fugacity
- 定義:化學勢與理想氣體的壓強的關係
- 物理學:(dG)=R*T*d(ln f)
逸度
用化學勢定義逸度
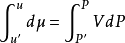



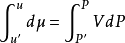



逸度(Fugacity)在化學熱力學中表示實際氣體的有效壓強,用 f 表示。逸度定義的出發點是化學勢與理想氣體的壓強的關係。它等於相同條件下具有相同化學勢的理想氣體的...
引入逸度和逸度係數的概念,對研究相平衡等非常有用,其中逸度係數是指逸度與壓力的比值。需要注意的是,理想氣體的逸度與壓力相等,另一方面,真實氣體的逸度係數是...
氣體B的逸度與其分壓力之比稱為逸度因子(通常稱為逸度係數),並用符號φ表示,即:φB=Pb*/pB。逸度因子的量綱為一。由於理想氣體的逸度等於其分壓力,故理想...
《環境多介質模型逸度方法》首次闡明了有毒有機污染物在大氣、水、土壤和底泥構成的多介質生態環境或生物圈中的行為歸趨以及它們對生物群落多樣性的影響,重點描述...
或運用逸度更為方便:在混合物中i組分在氣相和液相中的逸度相等,稱汽液平衡。 中文名 汽液平衡 外文名 Vapor-Liquid Equilibria 縮寫 VLE 歸結 氣相中組...
路易斯-蘭德爾規則(Lewis-Randall rule)是描述理想溶液的逸度與純物質逸度關係的規則。...
緩衝劑是能被用來控制高溫高壓狀態下,或常溫常壓下,氣體或液體逸度的固體組合,它可以是固態的也可以是液態的。化學工程中的緩衝劑常稱為酸鹼穩定劑,一般是鹽類,...
或運用逸度更為方便:在混合物中i組分在氣相和液相中的逸度相等,稱氣液平衡。中文名 氣液平衡 外文名 vapour-liquid equilibrium 含義 i組分在氣相和液相中...
流體包裹體熱力學,作者是劉斌,由地質出版社出版,是介紹作者多年來研究而建立的包裹體形成溫度、壓力、流體成分、流體逸度等熱力學參數計算方法、數表和公式,列舉了...
參考狀態是指在非理想的熱力學系統中,確定組分的逸度或活度的數值時所必須事先規定的某個狀態。...
路易斯·蘭德爾規則Lewis-Randall's rule 是混合氣體中某一組分的逸度的經驗式,表述為實際混合氣體中任一組分i的逸度等於該組分的摩爾分數與相同溫度及壓力時純...
全書的主要內容有流體的臨界性質、狀態方程、熱力學性質(焓、熵、熱容、相變焓和逸度等)、表面張力、溶液與相平衡性質和傳遞性質(黏度,導熱率和擴散係數等)等...
