造銅期(精銅冶煉的一個重要階段),在造銅期,隨著Cu2S的氧化,爐內熔體的體積逐漸減小,到造銅期終點出銅。出銅後迅速捅風眼,清除結塊。然後裝入銅鋶,開始下一爐次的吹煉。
基本介紹
- 中文名:造銅期
- 外文名:Copper phase
- 反應:物理化學反應
- 類型:造銅階段
- 目的:脫硫和銅氧化
- 套用:銅冶煉
簡介,造銅期物化反應,白冰銅氧化過程中的相變,轉爐富氧氧化,造銅期的反應動力學,
簡介
吹煉(converting)鼓風將液態氧化除去銅鋶中的鐵和硫,產出粗金屬或金屬富集物的火法冶金過程。銅的吹煉過程一般分為兩周期,第一周期是FeS的氧化造渣產出白銅銑(Cu2S),第二周期是Cu2S的氧化得到粗銅。一般稱第一周期為造渣期,第二周期為造銅期。鎳硫的吹煉只有第一周期,產出高鎳硫(Ni3S2),不繼續吹煉得粗鎳而另行處理。
吹煉作業是火法煉銅工序中不可缺少的作業,將空氣鼓入銅鋶熔體並與銅鋶熔體中的鐵、硫進行氧化反應放出熱量,維持自熱吹煉,經過造渣期和造銅期操作,生成粗銅。
在造銅期,隨著Cu2S的氧化,爐內熔體的體積逐漸減小,到造銅期終點出銅。出銅後迅速捅風眼,清除結塊。然後裝入銅鋶,開始下一爐次的吹煉。
造銅期物化反應
白冰銅氧化過程中的相變
按反應:Cu2S+O2(g)═ 2Cu(l)+SO2(g) (脫硫過程)
在吹煉中可取溫度1200℃,由於熔體Cu2S脫硫至19.80%(重量)即開始分層,直至含硫量為1.2%左右,才開始轉變為低硫單相熔體。因此在白冰銅吹煉期,長時間是在分層期進行氧化作業的。轉爐中的PSO2取0.1atm,平衡PO2=0.7atm。故
在吹煉中可取溫度1200℃,由於熔體Cu2S脫硫至19.80%(重量)即開始分層,直至含硫量為1.2%左右,才開始轉變為低硫單相熔體。因此在白冰銅吹煉期,長時間是在分層期進行氧化作業的。轉爐中的PSO2取0.1atm,平衡PO2=0.7atm。故
K = PSO2/PO2=106
反應平衡常數很大。因此,反應可用下列示意圖表示。
Cu2S+O2→ (Cu2S,SO2,Cu)→ (SO2,Cu)
Cu2S+O2→ (Cu2S,SO2,Cu)→ (SO2,Cu)
再從Cu-S系及Cu-O系相圖可以看出,當熔體含硫量等於20.14%(Cu2S化學計量成分),整個熔體為均勻的單相熔體。隨著氧化反應的進行,熔體的含硫量不斷降低,至圖中B點時開始分層。二液相共存,一層以Cu2S為主含有飽和金屬銅;另一層則以金屬銅為主含有飽和的硫,由於比重差的關係銅熔體在下部。繼續吹風,含硫量繼續減少,如圖中BC線段。至C點時熔體由二液相轉變為單相熔體,此時含硫量約在1.2%左右,單獨的Cu2S層已消失而代之以金屬銅,只含有少量的硫。視氧化程度和溫度條件,銅液中同時含少量硫和氧。圖中C-e線即為銅中含硫量與溫度的關係。繼續吹風,銅中含硫量還可降低,但含氧量則相應增多。在生產上為避免過吹,要嚴格控制脫硫的程度,一般含硫量在0.5%左右,即需停止吹風,從圖中還可看出,如吹煉控制不好,過吹的結果將使銅轉變為Cu+Cu2O,固溶體,至D點時,Cu2O開始析出並分層,吹煉將告失敗。
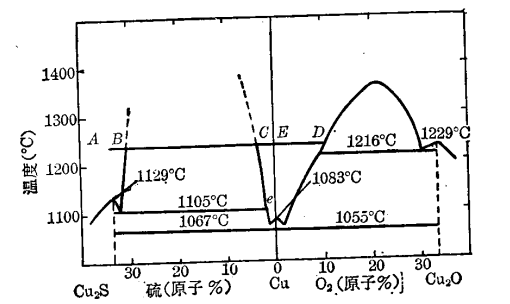 Cu—S—O系中Cu2S氧化的途徑(相圖依據)
Cu—S—O系中Cu2S氧化的途徑(相圖依據)轉爐富氧氧化
在粗銅生產期共存有爐氣一白冰銅一金屬鋼三相,其組分共有 Cu,S及O。因此,按相律決定體系狀態變數只有兩個,即溫度與氣相中的分壓(PO2或PSO2)。
從Cu-S系相平衡圖可以看出,白冰銅在吹煉期,脫硫反應在很大的範圍內處於分層區進行。這一段含硫量由19.80%降至1.2%(1200℃)。因此,討論強化過程在分層區具有重要實際意義。
按Cu2S-Cu系分層區的硫勢與溫度的關係:
log(Ps2)= -15505/T + 4.56
二氧化硫離解的硫勢和氧勢關係:
log(Ps21/2)= -18940/T+3.87 - log(PO2)+ log(PSO2)
又按吹煉生產作業的氣體組成見下表所示。
SO2(%) | SO3(%) | O2(%) | |||
一周期 | 二周期 | 一周期 | 二周期 | 一周期 | 二周期 |
13.71 | 17.0 | 0.91 | 2.5 | 0.3 | 0.3 |
12.47 | 16.51 | 0.97 | 1.91 | 0.13 | 0.13 |
11.13 | 13.81 | 3.22 | 4.16 | 0.53 | 0.42 |
12~13 | 15~17 | 2.0 | 3.0 | — | — |
表中示出二周期SO2+SO3平均達18%左右,自由氧波動在1.3×103—4.2×103atm。指定二周期平均溫度為1200℃,SO2=18%。
造銅期的反應動力學
造銅期的主要反應為白冰銅(Cu2S)的氧化,反應速率與熔體中的含硫量和供氧速度均有一定的關係。Cu2S的氧化產物會有不同的存在形態,因而使白冰銅的氧化過程變得複雜。在1193℃的溫度下用O2—Ar混合氣體(10%O2,90%Ar)氧化Cu2S熔體時,熔體的質量變化ΔW與反應時間t的關係如下圖所示。由圖可見,Cu2S的氧化過程可以分成兩個不同的階段:第一階段為Cu2S的脫硫反應,熔體的質量隨反應的進行而減小;第二階段為Cu的氧化反應,熔體的質量隨反應的進行而增大。
這種現象可以用Cu-S系和Cu-O系相圖進行說明。從下圖可以看出,當熔體含硫量等於33.3%(原子百分數)時,熔體完全由Cu2S組成,體系處於均勻的單相區,如圖中a點所示。隨著氧化反應的進行,熔體含硫量開始下降,並有少量的金屬銅生成,但生成的金屬銅能夠完全溶解在白冰銅中,熔體仍處於單相區,此時,反應速率與熔體含硫量成正比,如圖中曲線a-b段所示,故
-dΔW/dt= k1Csn
式中,k1為表觀速率常數;Cs為熔鋶的含硫量,n為經驗常數。
隨著反應的繼續進行,當熔體含硫量降低到圖中b點時,金屬銅在Cu2S熔體中的濃度達到飽和並析出,熔體開始分層,上層為含有飽和金屬銅的Cu2S熔體,下層為含有飽和Cu2S的銅熔體,體系處於兩相共存區。此時,氧化反應只改變熔鋶和金屬的相對數量,而不改變它們的化學組成,故熔鋶的含硫量在反應中保持不變,脫硫速度為一常數,如圖7—18中曲線b-c段所示,因此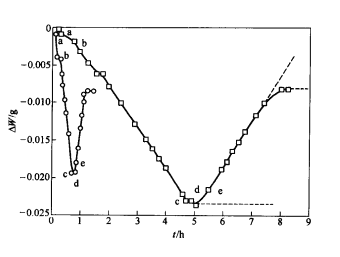 Cu2S熔體氧化時質量變化與時間的關係
Cu2S熔體氧化時質量變化與時間的關係
 Cu2S熔體氧化時質量變化與時間的關係
Cu2S熔體氧化時質量變化與時間的關係-dΔW/dt= k2
式中,k2為常數。
當體系的含硫量降低到c點時,Cu2S熔體氧化時質量變化與時間的關係熔鋶相完全消失,體系中只有金屬相存在,其中的含硫量很低。隨著含硫量的降低,脫硫速度不斷減小,如圖中曲線c-d段所示,此時,反應速率可以表示為
-dΔW/dt = k3Csm
式中,k3為表觀速率常數;Cs為銅液的含硫量;m為經驗常數。
最後,當體系中的含硫量為零時,反應速率也等於零,如圖中曲線的d點所示。此後,如繼續氧化,則金屬銅液將被氧化,銅中含氧量將不斷增加,質量變化將轉變為正值,如圖中曲線d-e段所示。待氧化反應進行到e點時,體系又開始分層,氧化速率再次發生轉折。
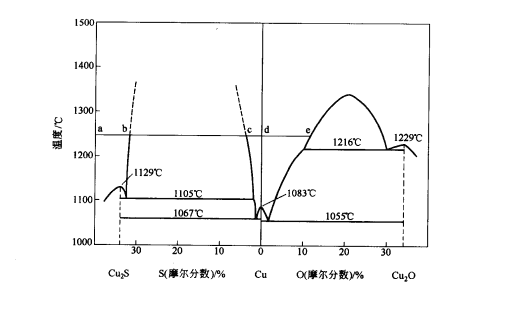 Cu—S系和Cu一O系相圖
Cu—S系和Cu一O系相圖