通常情況下,水以蒸汽、液態和冰三種常見的狀態存在,且是極性溶劑,可以溶解包括鹽在內的大多數電解質,對氣體和大多數有機物則微溶或不溶。
基本介紹
- 中文名:超臨界技術
- 外文名:Supercritical technology
- 原理:超臨界水氧化
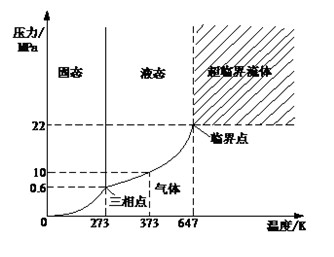
- 臨界點:Tc=374.3℃,Pc=22.1MPa
基本原理
溶質 | 普通水 | 超臨界水 |
無機物 | 大部分易溶 | 微溶或不溶 |
有機物 | 大部分微溶或不溶 | 易溶 |
氣體 | 大部分微溶或不溶 | 易溶 |
通常情況下,水以蒸汽、液態和冰三種常見的狀態存在,且是極性溶劑,可以溶解包括鹽在內的大多數電解質,對氣體和大多數有機物則微溶或不溶。


溶質 | 普通水 | 超臨界水 |
無機物 | 大部分易溶 | 微溶或不溶 |
有機物 | 大部分微溶或不溶 | 易溶 |
氣體 | 大部分微溶或不溶 | 易溶 |
工程上,將某流體所處的壓力(P)和溫度(T)均超過臨界壓力(Pc)和臨界溫度(Tc)時的這種狀態稱為超臨界。...
火電廠超超臨界機組和超臨界機組指的是鍋爐內工質的壓力。鍋爐內的工質都是水,水的臨界參數是:22.129MPa、374.15℃ ;在這個壓力和溫度時,水和蒸汽的密度是...
超超臨界發電技術的發展至今已有半個多世紀的歷史。從20世紀50年代起,以英國、德國和日本為代表,就開始了對超超臨界發電技術的開發和研究,而且起步就是超越臨界...
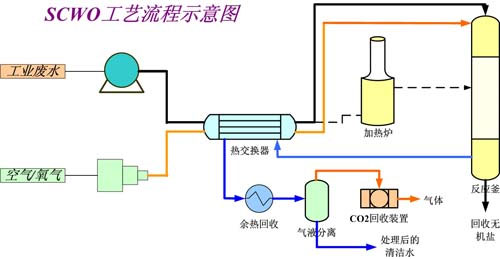
超臨界水氧化技術是使廢水在水的超臨界條件(P>218atm, T>374℃)下與氧化劑(O2、Air、H2O2等)反應,把廢水中含有的有機物分解成無害成份的技術在臨界點以下的...
超臨界流體(supercritical fluid) 是溫度、壓力高於其臨界狀態的流體。溫度與壓力都在臨界點之上的物質狀態歸之為超臨界流體。超臨界流體具有許多獨特的性質,如粘度...
火電廠超超臨界機組和超臨界機組指的是鍋爐內工質的參數達到或超過臨界壓力以上的機組。鍋爐內的工質都是水,水的臨界壓力是22.129MPa,臨界溫度是374.15℃ ;在...
物質的壓力和溫度同時超過它的臨界壓力(Pc)和臨界溫度(Tc)的狀態,或者說,物質的對比壓力(P/Pc)和對比溫度(T/Tc)同時大於1的狀態稱為該物質的超臨界狀態。超...
超臨界為超臨界流體,是介於氣液之間的一種既非氣態又非液態的物態,這種物質只能在其溫度和壓力超過臨界點時才能存在。超臨界流體的密度較大,與液體相仿,而它的...
超超臨界發電技術從熱力學的角度上講其本質還是超臨界技術,只是日本人將蒸汽壓力在26MPa以上的機組均劃分為超超臨界機組,由此得名。...
《超臨界流體技術及套用》是2014年10月化學工業出版社出版的圖書,作者是李淑芬、張敏華。...
超臨界水氧化技術是在溫度、壓力高於水的臨界溫度(374.3℃)和臨界壓力(22.1MPa)條件下,以超臨界水作為反應介質來氧化分解有機物。在超臨界水氧化過程中,由於超...
超臨界流體萃取(SFE,簡稱超臨界萃取)是一種將超臨界流體作為萃取劑,把一種成分(萃取物)從混合物(基質)中分離出來的技術。二氧化碳(CO2)是最常用的超臨界流體。....
超臨界水氧化(Supercritical Water Oxidation,簡稱SCWO)技術是一種可實現對多種有機廢物進行深度氧化處理的技術。超臨界水氧化是通過氧化作用將有機物完全氧化為清潔...
超臨界鍋爐是指鍋爐內工質的壓力在臨界點以上的鍋爐。隨著超臨界鍋爐的發展,將會比之間更加的節能減排,環保。...
《超臨界流體技術在幾種天然產物研究中的套用》是張焜著,陳耀祖教授指導的論文。...... 《超臨界流體技術在幾種天然產物研究中的套用》是張焜著,陳耀祖教授指導的論...
