基本介紹
- 中文名:質子轉移反應
- 外文名:Proton transfer reaction
- 別稱:酸鹼反應
- 參與反應:質子給體、受體
反應類型
製取弱酸和弱鹼
質譜法
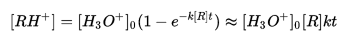 反應方程式
反應方程式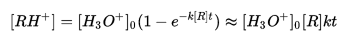 反應方程式
反應方程式質子轉到受體的反應,稱為質子轉移反應。反應是質子給體A和受體B間有質子轉移的反應。如HA+B-→HB+A-,故也稱酸鹼反應。其反應機理有兩類:(1)質子直接轉移,...
電離機理為確保電離所需的質子轉移反應發生,待測揮發性有機物的質子親合勢需要比水高。大多數的揮發性有機物都滿足這個條件,也意味著可以被檢測到。另一方面,...
化學平衡中,每一給定的分析濃度等於各存在型體平衡濃度之和,溶液呈電中性,荷正電的質點數應等於荷負電的質點數,酸鹼反應達平衡時酸失去的質子數等於鹼得到的質子...
電子轉移(Electron transfer,ET),是指電子在兩個原子或其他化學物質(如分子等)之間的移動。電子轉移是一種氧化還原反應,會改變兩個反應物的氧化態。...
在多數情況下,選擇某個酸HA作為參考,測量它與物質B之間的質子轉移反應(如式①),可將反應①視為反應②與③之差,則測出的ΔH體現了B與A-的質子親和能之差,...
7 1 8光化學反應機理的確定1527 2聲化學1527 3微波化學153參考文獻154第8章酸和鹼1588 1Br nsted理論1588 2質子轉移反應的機理161...
質子轉移反應質譜監測儀是由中科院安徽光機所承擔的中科院科研裝備研製項目。...... 質子轉移反應質譜監測儀是由中科院安徽光機所承擔的中科院科研裝備研製項目。...
目前主要研究方向有:共振拉曼光譜與低溫基質隔離等交叉技術研究;光解離、光異構化、光誘導電子轉移和質子轉移反應動力學研究;瞬態中間體檢測和鑑定;反應機理研究;量子...
研究並開發了多種新型質譜離子源,並形成多項專利 [5] ;研發了具有自主智慧財產權的快回響高靈敏質子轉移反應質譜儀用於實時線上監測多種揮發性有機污染物 [5] ;...
比如說,質子轉移反應發生需要特定的條件,這些離子化手段稱為質子轉移(Proton Transfer Reaction, PTR)。其中,水的親核能(Proton affinity)為707kJ/mol,而乙醇為770...
酸鹼滴定法是指利用酸和鹼在水中以質子轉移反應為基礎的滴定分析方法。可用於測定酸、鹼和兩性物質,是一種利用酸鹼反應進行容量分析的方法。用酸作滴定劑可以測定鹼...
朱守非長期從事催化有機合成化學研究,重點研究了幾類以氫轉移為關鍵步驟的重要有機合成反應,主要取得以下成果:1)在質子轉移反應方面,提出了“手性質子梭”概念,為不...
從化學反應的類型分,有正化學電離和負化學電離。正化學電離發生的分子-離子反應主要有質子轉移反應、電荷交換反應、親電加成反應;負化學電離發生的分子-離子反應主要...
研究室擁有儀器和實驗平台主要包括:自主研製的質子轉移反應質譜儀、呼氣揮發性有機物線上檢測質譜儀、非放射源離子遷移譜儀、離子遷移譜-質譜實驗裝置、重金屬光譜...
酸鹼之間的反應也就是質子的轉移,鹼利用孤對電子從酸中奪取質子生成其共軛酸,酸則成為其共軛鹼。鹼的鹼性越強,其共軛酸的酸性則越弱;同樣,酸的酸性越強,其...
《分子內激發態質子轉移反應的理論研究》、《有機分子非線性光學性質的理論研究》、《金屬碳籠的結構和性質的理論研究》、《超分子的結構與非線性光學性質》,《...
非水溶液滴定法是質子傳遞反應為基礎的在水以外的溶劑中滴定的方法。...... 溶劑分子結合成溶劑合質子,酸鹼中和反應的實質是質子的轉移,而質子轉移是通過溶劑和質子...
(1)氫鍵及質子轉移反應的理論研究:利用計算化學手段對廣泛存在於溶液、界面及生命現象中的氫鍵的形成和影響(各種譜學性質)進行研究,並進一步考察該作用的形成對質子...
酸鹼滴定就是利用酸和鹼在水中以質子轉移反應為基礎的滴定分析方法。可用於測定酸、鹼和兩性物質。其基本反應為H﹢+OH﹣=H2O也稱中和法,是一種利用酸鹼反應進行...
(1)氫鍵及質子轉移反應的理論研究:利用計算化學手段對廣泛存在於溶液、界面及生命現象中的氫鍵的形成和影響(各種譜學性質)進行研究,並進一步考察該作用的形成對質子...
▪ 酸鹼的相對強度 ▪ 酸鹼滴定法 ▪ 酸鹼指示劑 ▪ 酸鹼質子理論 ▪...▪ 相對標準偏差 ▪ 相轉移催化作用 ▪ 消除反應 ▪ 硝酸 ▪ 校正...
3.2.2 質子轉移反應類型的滴定3.3 電子轉移反應類型的滴定3.3.1 對稱型滴定反應3.3.2 非對稱型滴定反應習題第4章 滴定分析法的套用...
4.2化學電離中的離子一分子反應4.2.1質子轉移反應4.2.2電荷交換反應4.2.3氫負離子轉移反應4.2.4加合與締合反應4.2.5特殊反應4.3化學電離試劑體系...
(十一)實現質子轉移反應質譜儀的成果轉化;(十二)實現全自動模組式呼出氣體酒精含量探測器檢定裝置的成果轉化;(十三)實現數位化X射線攝影系統計量標準裝置的成果轉化。...
由於同種電荷間的排斥力,離子聚合不發生雙分子終止反應,負離子聚合又不易進行鏈轉移,所以終止反應需要在外加物質(能提供質子的化合物)存在下進行。...
研究方向主要是多光子電離質譜,分子團簇,圍繞醇類團簇的結構、穩定性和電離後的質子轉移反應生成質子化團簇的機理等問題,利用飛行時間質譜儀,結合從頭算方法對實驗結果...
(十一)實現質子轉移反應質譜儀的成果轉化;(十二)實現全自動模組式呼出氣體酒精含量探測器檢定裝置的成果轉化;(十三)實現數位化X射線攝影系統計量標準裝置的成果轉化。...
