基本介紹
- 中文名:膜片鉗技術
- 外文名:patch clamp
- 1976年:德國馬普生物物理研究所
- 創建:Neher和Sakmann
- 技術:膜片鉗技術
簡介,發展歷史,技術原理,膜片鉗,膜片鉗法的各種模式,細胞吸附模式,膜內面向外模式,膜外面向內模式,開放細胞吸附膜內面向外模式,穿孔囊泡膜外面向外模式,常規全細胞模式,操作步驟,套用學科,標本種類,研究對象,套用舉例,
簡介
膜片鉗技術是用微玻管電極(膜片電極或膜片吸管)接觸細胞膜,以千兆歐姆以上的阻抗使之封接,使與電極尖開口處相接的細胞膜的小區域(膜片)與其周圍在電學上分隔,在此基礎上固定點位,對此膜片上的離子通道的離子電流(pA級)進行監測記錄的方法
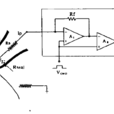
用場效應管運算放大器構成的I-V轉換器是測量迴路的核心部分。在場效應管運算放大器的正負輸入端子為等電位,向正輸入端子施加指令電位時,由於短路負端子以及膜片都可等電位地達到鉗制的目的,當膜片微電極尖端與默片之間形成10GΩ以上封接時,其間的分流電流達到最小,橫跨膜片的電流可100%作為來自膜片電極的記錄電流(lp)而被測量出來。
這一偉大的貢獻,使Neher和Sakmann獲得1991年度的諾貝爾生理學與醫學獎。
發展歷史
該技術是由電壓鉗(voltageclamp)發展而來的,電壓鉗技術由Cole和Marment設計,後經Hodgkin和Huxley改進並成功地套用於神經纖維動作電位的研究。其設計原理是根據離子作跨膜移動時形成了跨膜離子電流(I),而通透性即離子通過膜的難易程度,其膜電阻(R)的倒數,也就是膜電導(G)。因此,膜對某種離子通透性增大時,實際上時膜電阻變小,即膜對該離子的電導加大。根據歐姆定律U=IR,即I=U/R=UG,所以,只要固定膜兩側電位差(U)時,測出的跨膜電流(I)的變化,就可作為膜電導變化的度量,即可了解膜通透性的改變情況。
1976年德國馬普生物物理化學研究所Neher和Sakmann首次在青蛙肌細胞上用雙電極鉗制膜電位的同時,記錄到ACh激活的單通道離子電流,從而產生了膜片鉗技術。
1980年Sigworth等在記錄電極內施加5-50 cmH2O的負壓吸引,得到10-100GΩ的高阻封接(Giga-seal),大大降低了記錄時的噪聲實現了單根電極既鉗制膜片電位又記錄單通道電流的突破。
1981年Hamill和Neher等對該技術進行了改進,引進了膜片游離技術和全細胞記錄技術,從而使該技術更趨完善,具有1pA的電流靈敏度、1μm的空間解析度和10μs的時間解析度。
技術原理
膜片鉗技術是用玻璃微電極吸管把只含1-3個離子通道、面積為幾個平方微米的細胞膜通過負壓吸引封接起來,由於電極尖端與細胞膜的高阻封接,在電極尖端籠罩下的那片膜事實上與膜的其他部分從電學上隔離,因此,此片膜內開放所產生的電流流進玻璃吸管,用一個極為敏感的電流監視器(膜片鉗放大器)測量此電流強度,就代表單一離子通道電流。
膜片鉗技術的建立,對生物學科學特別是神經科學是一具有重大意義的變革。這是一種以記錄通過離子通道的離子電流來反映細胞膜單一的(或多個)的離子通道分子活動的技術。此技術的出現自然將細胞水平和分子水平的生理學研究聯繫在一起,同時又將神經科學的不同分野必然地融匯在一起,改變了既往各個分野互不聯繫、互不滲透,阻礙人們全面認識能力的弊端。
膜片鉗
膜片鉗技術被稱為研究離子通道的“金標準”。是研究離子通道的最重要的技術。目前膜片鉗技術已從常規膜片鉗技術(Conventional patch clamp technique)發展到全自動膜片鉗技術(Automated patch clamp technique)。
傳統膜片鉗技術每次只能記錄一個細胞(或一對細胞),對實驗人員來說是一項耗時耗力的工作,它不適合在藥物開發初期和中期進行大量化合物的篩選,也不適合需要記錄大量細胞的基礎實驗研究。全自動膜片鉗技術的出現在很大程度上解決了這些問題,它不僅通量高,一次能記錄幾個甚至幾十個細胞,而且從找細胞、形成封接、破膜等整個實驗操作實現了自動化,免除了這些操作的複雜與困難。這兩個優點使得膜片鉗技術的工作效率大大提高了!簽於全自動膜片鉗技術的這些優點,目前已經廣泛的用於藥物篩選。
膜片鉗法的各種模式
圖1是表示膜片鉗法各種模式的模式圖,首先建立的單通道記錄是細胞吸附式,其後又建立了膜內面向外和膜外面向內的模式。最近,又分別建立了開放的細胞吸附式膜內面向外和穿孔囊泡膜外面向外的模式。全細胞記錄法是指在常規的方法的基礎上,附加穿孔膜片的模式。 圖1 膜片鉗法的各種模式
圖1 膜片鉗法的各種模式
 圖1 膜片鉗法的各種模式
圖1 膜片鉗法的各種模式細胞吸附模式
將膜片微電極吸附在細胞膜上對但離子通道電流進行記錄的模式。其優點是在細胞內環境保持正常的條件下可以對離子通道活動進行觀察記錄。但是由於不能認為直接地控制細胞內環境條件也不能確切的潘明細胞內點位,所以其缺點是不清楚膜片上的實效點位。
膜內面向外模式
從細胞吸附模式將已形成巨阻抗封接的膜片微電極向上提起時,則膜片即從細胞體上被切割分隔下來,形成膜內面向外的模式。
膜外面向內模式
從全細胞模式將膜片微電極向上提起可得到切割分離的膜片,由於它的細胞膜內側面面對膜片微電極腔內液,膜外面自然封閉而對外,所以這個模式被稱為莫外面向內模式。
開放細胞吸附膜內面向外模式
將細胞吸附模式的膜片以外的某部位的胞膜進行機械地破壞,經破壞孔調控細胞內液並在細胞吸附狀態下進行內面向外的單一離子通道記錄。
穿孔囊泡膜外面向外模式
從穿孔膜片模式將膜片微電極向上提起,便在微電極尖端處形成一個膜囊泡,如果條件較好,此膜囊泡內不僅有細胞質因子還可有線粒體等細胞器存在。
常規全細胞模式
在細胞吸附模式上將膜打穿成孔,記錄膜片以外部位的全細胞膜的離子電流,這時全細胞模式。
操作步驟
(1)膜片微電極的製作
拉制 拉制過程
拉制過程
 拉制過程
拉制過程膜片微電極是將玻璃毛細管用拉管儀拉制而成。
塗矽酮樹酯
將矽酮樹酯塗於微電極的最尖端以外的部分,然後將其通過加熱鎳鉻電阻線圈而烘乾變固。
熱刨光
在顯微鏡下,將微電極尖端接近熱源進行熱刨光處理可提高巨阻抗封接的成功率。
充灌微電極液
用於灌充微電極的液體需經為空濾膜過濾,出去妨礙巨阻抗封接形成的灰塵。
(2)巨歐姆阻抗封接
(3)單一離子通道記錄
(4)全細胞記錄
(5)制真菌素穿孔膜片鉗法
(6)膜片電容測定法
(7)參數補償
套用學科
膜片鉗技術發展至今,已經成為現代細胞電生理的常規方法,它不僅可以作為基礎生物醫學研究的工具,而且直接或間接為臨床醫學研究服務,
目前膜片鉗技術廣泛套用於神經(腦)科學、心血管科學、藥理學、細胞生物學、病理生理學、中醫藥學、植物細胞生理學、運動生理等多學科領域研究。
隨著全自動膜片鉗技術(Automatic patch clamp technology)的出現,膜片鉗技術因其具有的自動化、高通量特性,在藥物研發、藥物篩選中顯示了強勁的生命力。
標本種類
使用的標本種類繁多。從最早的肌細胞(心肌、平滑肌、骨骼肌)、神經元和內分泌細胞發展到血細胞、肝細胞、耳窩毛細胞、胃壁細胞、上皮細胞、內皮細胞、免疫細胞、精母細胞等多種細胞;從急性分散細胞和培養細胞(包括細胞株)發展到組織片(如腦片、脊髓片)乃至整體動物;從蝸牛、青蛙、蠑螈、爪蟾卵母細胞發展到雞細胞、大鼠細胞、人細胞等等;從動物細胞發展到細菌、真菌以及植物細胞。此外,膜片鉗技術還廣泛地套用到平面雙分子層(Planar bilayer)、脂質體(Liposome)等人工標本上。
研究對象
研究對象已經不局限於離子通道。從對離子通道(配體門控性、電壓門控性、第二信使介導的離子通道、機械敏感性離子通道以及縫隙連線通道等等)的研究發展到對離子泵、交換體以及可興奮細胞的胞吞、胞吐機制的研究等。
套用舉例
(1)膜片鉗技術在通道研究中的重要作用
套用膜片鉗技術可以直接觀察和分辨單離子通道電流及其開閉時程、區分離子通道的離子選擇性、同時可發現新的離子通道及亞型,並能在記錄單細胞電流和全細胞電流的基礎上進一步計算出細胞膜上的通道數和開放機率,還可以用以研究某些胞內或胞外物質對離子通道開閉及通道電流的影響等。同時用於研究細胞信號的跨膜轉導和細胞分泌機制。結合分子克隆和定點突變技術,膜片鉗技術可用於離子通道分子結構與生物學功能關係的研究。
利用膜片鉗技術還可以用於藥物在其靶受體上作用位點的分析。如神經元菸鹼受體為配體門控性離子通道,膜片鉗全細胞記錄技術通過記錄菸鹼誘發電流,可直觀地反映出神經元菸鹼受體活動的全過程,包括受體與其激動劑和拮抗劑的親和力,離子通道開放、關閉的動力學特徵及受體的失敏等活動。使用膜片鉗全細胞記錄技術觀察拮抗劑對菸鹼受體激動劑量效曲線的影響,來確定其作用的動力學特徵。然後根據分析拮抗劑對受體失敏的影響,拮抗劑的作用是否有電壓依賴性、使用依賴性等特點,可從功能上區分拮抗劑在菸鹼受體上的不同作用位點,即判斷拮抗劑是作用在受體的激動劑識別位點,離子通道抑或是其它的變構位點上。
(2)與藥物作用有關的心肌離子通道
心肌細胞通過各種離子通道對膜電位和動作電位穩態的維持而保持正常的功能。近年來,國外學者在人類心肌細胞離子通道特性的研究中取得了許多進展,使得心肌藥理學實驗由動物細胞模型向人心肌細胞成為可能。
(3)對離子通道生理與病理情況下作用機制的研究
通過對各種生理或病理情況下細胞膜某種離子通道特性的研究,了解該離子的生理意義及其在疾病過程中的作用機制。如對鈣離子在腦缺血神經細胞損害中作用機制的研究表明,缺血性腦損害過程中,Ca2+ 介導現象起非常重要的作用,缺血缺氧使Ca2+通道開放,過多的Ca2+進入細胞內就出現Ca2+超載,導致神經元及細胞膜損害,膜轉運功能障礙,嚴重的可使神經元壞死
(4)對單細胞形態與功能關係的研究
將膜片鉗技術與單細胞逆轉錄多聚酶鏈是反應技術結合,在全細胞膜片鉗記錄下,將單細胞內容物或整個細胞(包括細胞膜)吸入電極中,將細胞記憶體在的各種mRNA全部快速逆轉錄成cDNA,再經常規PCR擴增及待檢的特異mRNA的檢測,藉此可對形態相似而電活動不同的結果做出分子水平的解釋或為單細胞逆轉錄多聚酶鏈式反應提供標本,為同一結構中形態非常相似但功能不同的事實提供分子水平的解釋。目前國際上掌握此技術的實驗室較少,我國北京大學神經科學研究所於1994年在國內率先開展。
(5)對藥物作用機制的研究
在通道電流記錄中,可分別於不同時間、不同部位(膜內或膜外)施加各種濃度的藥物,研究它們對通道功能的可能影響,了解那些選擇性作用於通道的藥物影響人和動物生理功能的分子機理。這是目前膜片鉗技術套用最廣泛的領域,既有對西藥藥物機制的探討,也廣泛用在重要藥理的研究上。如開麗等報導細胞貼附式膜片鉗單通道記錄法觀測到人參二醇組皂苷可抑制正常和“缺血”誘導的大鼠大腦皮層神經元L-型鈣通道的開放,從而減少鈣內流,對缺血細胞可能有保護作用。陳龍等報導採用細胞貼附式單通道記錄法發現烏頭鹼對培養的Wistar大鼠心室肌細胞L-型鈣通道有阻滯作用。
(6)在心血管藥理研究中的套用
隨著膜片鉗技術在心血管方面的廣泛套用,對血管疾病和藥物作用的認識不僅得到了不斷更新,而且在其病因學與藥理學方面還形成了許多新的觀點。正如諾貝爾基金會在頒獎時所說:“Neher和Sadmann的貢獻有利於了解不同疾病機理,為研製新的更為特效的藥物開闢了道路”。
(7)創新藥物研究與高通量篩選
目前在離子通道高通量篩選中主要是進行樣品量大、篩選速度占優勢、信息量要求不太高的初級篩選。最近幾年,分別形成了以膜片鉗和螢光探針為基礎的兩大主流技術市場。將電生理研究信息量大、靈敏度高等特點與自動化、微量化技術相結合,產生了自動化膜片鉗等一些新技術。
(8)在神經科學中的套用
膜片鉗技術與離體腦片技術結合,可以定位研究神經元離子通道,還可以進行神經元突觸聯繫的研究,與使用培養的或急性分散的神經元相比具有不可替代的優勢。