能級躍遷首先由波爾(Niels Bohr)提出,但是波爾將巨觀規律用到其中,所以除了氫原子的能級躍遷之外,在對其他複雜的原子的躍遷規律的探究中,波爾遇到了很大的困難。
基本介紹
- 中文名:能級躍遷
- 外文名:energy level transition
- 原理簡介:原子中電子的躍遷
- 詳細內容:氫原子能級
- 半徑公式:r(n)=n^2*r(1)
原理簡介
詳細內容
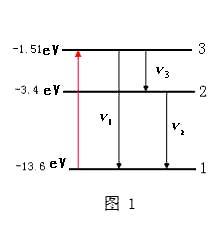 氫原子能級圖
氫原子能級圖補充說明
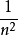
能級躍遷首先由波爾(Niels Bohr)提出,但是波爾將巨觀規律用到其中,所以除了氫原子的能級躍遷之外,在對其他複雜的原子的躍遷規律的探究中,波爾遇到了很大的困難。
 氫原子能級圖
氫原子能級圖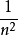
由玻爾的理論發展而來的現代量子物理學認為原子核外電子的可能狀態是不連續的,因此各狀態對應能量也是不連續的。這些能量值就是能級。能級是用來表達在一定能層上(K...
能級躍遷首先由波爾(Niels Bohr)提出,但是波爾將巨觀規律用到其中,所以除了氫原子的能級躍遷之外,在對其他複雜的原子的躍遷規律的探究中,波爾遇到了很大的困難。...
躍遷,即量子力學體系狀態發生跳躍式變化的過程。原子在光的照射下從高(低)能態跳到低(高)能態發射(吸收)光子的過程就是典型的量子躍遷。即使不受光的照射,處於...
能級(energy level)理論最初是為了解釋原子核外電子運動軌道而發展起來的一種理論。它認為電子只能在特定的、分立的軌道上運動,各個軌道上的電子具有分立的能量,...
原子(或分子、離子)總是力圖使自己的能量狀態處於基態上,被激發到高能級後的粒子,力圖回到基態上去,與此同時放出激發時所吸收的能量。基態是粒子能量最平衡最...
電子躍遷本質上是組成物質的粒子(原子、離子或分子)中電子的一種能量變化。根據能量守恆原理,粒子的外層電子從低能級轉移到高能級的過程中會吸收能量;從高能級轉移...
由玻爾的理論發展而來的現代量子物理學認為原子核外電子的可能狀態是不連續的,因此各狀態對應能量也是不連續的。這些能量值就是能級。能級是用來表達在一定能層上(K...
量子躍遷,就是微觀狀態發生跳躍式變化的過程。由於微觀粒子的狀態常常是分立的,所以從一個狀態到另一個狀態的變化常常是跳躍式的。量子躍遷發生之前的狀態稱為初態...
自發躍遷是指原子被激發到高能級後,除了可以通過碰撞釋放出能量外,還有可能自發地從高能級躍遷到低能級,把多餘的能量以自發輻射形式放出去,這種過程也就是自發躍遷...
原子(或分子、離子)總是力圖使自己的能量狀態處於基態上,被激發到高能級後的粒子,力圖回到基態上去,與此同時放出激發時所吸收的能量。...
能級間的躍遷編輯 鎖定 本詞條缺少信息欄、名片圖,補充相關內容使詞條更完整,還能快速升級,趕緊來編輯吧!詞條標籤: 科學 V百科往期回顧 詞條統計 瀏覽次數:次 ...
1 量子力學名詞,在適當的條件下,原子、分子和原子核等體系可能從這個狀態過渡到任何一個其他可能的狀態,這種狀態的過渡稱為躍遷。單位時間中這種躍遷的比率,叫做...
原子能級是指原子系統能量量子化的形象化表示。按照量子力學理論,可計算出原子系統的能量是量子化的,能量取一系列分立值;能量值取決於一定的量子數,因此能級用一定...
相同角量子數(即△l = 0)之間的電子躍遷是禁阻的,△l =±1之間的電子躍遷是允許的,如d↔d,p↔p,f↔f 躍遷是禁阻的,而s↔p,p↔d,d↔f躍遷...
氫原子光譜指的是氫原子內的電子在不同能級躍遷時所發射或吸收不同波長、能量之光子而得到的光譜。...
原子或分子吸收一定的能量後,電子被激發到較高能級但尚未電離的狀態。激發態一般是指電子激發態,氣體受熱時分子平動能增加,液體和固體受熱時分子振動能增加,但沒有...
