核心組蛋白,染色體核心組蛋白分子作為各種炎症因子和炎症信號轉錄“開關”分子的功能,其活性受組蛋白轉乙醯酶/脫乙醯酶(HAT/HDAC)的調節。HAT活性增高,組蛋白分子過乙醯化,DNA表現為解鏈效應,促進基因轉錄;而HDAC活性增高則出現相反的效應,基因轉錄變沉默。HAT和HDAC的動態平衡對基因的轉錄活性和炎症反應程度的調節起關鍵作用。
基本介紹
- 中文名:核心組蛋白
- 外文名:Core histone
- 含義 :炎症信號轉錄“開關”分子的功能
- 意義:調節起關鍵作用
- 實質:蛋白
成分組分,合成後修飾,非組蛋白,
成分組分
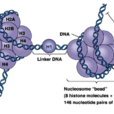
幾乎所有真核細胞染色體的組蛋白均可分成5種主要的組分,分別用字母或數字命名,命名方法也不統一,如H1或稱F1,Ⅰ;H2A或稱F2A2,Ⅱb1;H2B或稱F2B,Ⅱb2;H3或稱F3,Ⅲ;H4或稱F2A1,Ⅳ。有核的紅細胞或個別生物體中,還存在特別的組蛋白成分,紅細胞中為H5或F2C,Ⅴ,鮭魚組織中為H6或T。H2A、H2B、H3、H4組成核小體的核心,也稱核心組蛋白。根據組蛋白的一級結構,又可將它們分為3種類型:賴氨酸含量特別豐富的組蛋白(H1);賴氨酸含量較豐富的組蛋白(H2A和H2B);精氨酸含量豐富的組蛋白(H3和H4)。從整體來說,組蛋白在進化過程中保守性很強。其中H1變化較大,H3和H4變化最小。如對小牛胸腺的5種組蛋白,豌豆苗組蛋白的H3、H4和兔胸腺組蛋白H1等的一級結構比較中發現,小牛胸腺和豌豆苗的組蛋白H4間只在60位和77位上的兩個胺基酸殘基不同。但已知的真菌和原生動物的組蛋白的部分一級結構和動、植物的組蛋白間的差異較大。
合成後修飾
這是形成組蛋白各組分微不均一性的主要原因。修飾的方式有:①乙醯化。有兩種,一種是H1、H2A、H4組蛋白的氨基末端乙醯化,形成-乙醯絲氨酸,組蛋白在細胞質內合成後輸入細胞核之前發生這一修飾。二是在H2A、H2B、H3、H4的氨基末端區域的某些專一位置形成-乙醯賴氨酸。②磷酸化。所有組蛋白的組分均能磷酸化,在期間,H1的1~3個絲氨酸可以磷酸化。而在時期,H1有3~6個絲氨酸或蘇氨酸發生磷酸化,其他四個核心組蛋白的磷酸化可以發生在氨基末端區域的絲氨酸殘基上。組蛋白的磷酸化可能會改變組蛋白與DNA的結合。③甲基化。僅發現於H3的9和27位和H4的20位的賴氨酸,鴨紅細胞組蛋白H1和H5的組氨酸。④ADP-核糖基化。組蛋白H1、H2A、H2B及H3和多聚ADP-核糖的共價結合,ADP-核糖基化被認為是在真核細胞內啟動複製過程的扳機。
非組蛋白
染色質中一大群分子量5000~15000的蛋白質的總稱。真核細胞的非組蛋白可能有100種以上。由於非組蛋白本身具有聚合特性,它們和組蛋白、核酸等也有結合能力,用電泳和層析技術完全分離非組蛋白比較困難,用雙向電泳技術曾在兔肝和諾維科夫肝癌細胞分別分離到69個和84個組分。非組蛋白大致包含下列三類蛋白質:①細胞核內大量的酶。包括DNA合成及修復過程中的DNA多聚酶和連線酶,核糖核酸(RNA)聚合酶,以及核酸和蛋白質如組蛋白在修飾過程中所需要的酶;②在染色體中起結構作用的蛋白質;③其他尚未闡明功能的蛋白質。非組蛋白在各種組織和細胞的分化及發育過程中以及在正常向腫瘤細胞的轉化過程中均會發生變化。各種不同的動物和組織中的非組蛋白成分也有較大的變化。非組蛋白能夠選擇性地和同源DNA結合,它們在RNA聚合酶作用下在體外能促進DNA的,所以有人認為染色質中的具有專一功能的非組蛋白在轉錄的選擇性調控上起重要作用。