細胞轉染是指將外源分子如DNA,RNA等導入真核細胞的技術。隨著分子生物學和細胞生物學研究的不斷發展,轉染已經成為研究和控制真核細胞基因功能的常規工具。在研究基因功能、調控基因表達、突變分析和蛋白質生產等生物學試驗中,其套用越來越廣泛。
基本介紹
- 中文名:細胞轉染
- 技術內容:將外源分子導入真核細胞
- 研究內容:研究和控制真核細胞基因功能
- 套用:蛋白質生產等生物學試驗中
定義
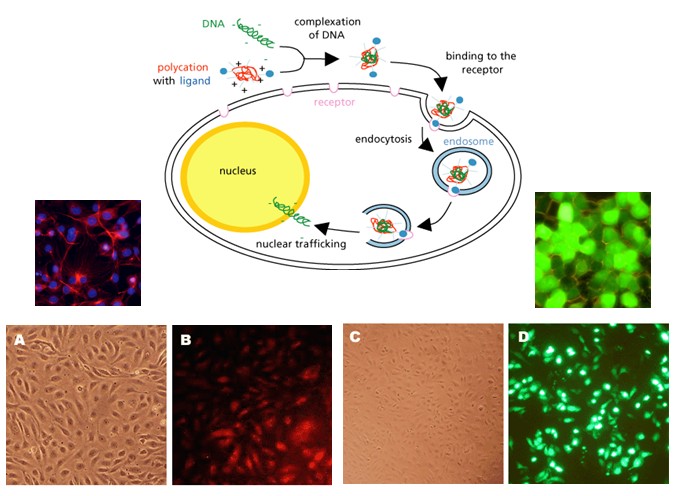
細胞轉染是指將外源分子如DNA,RNA等導入真核細胞的技術。隨著分子生物學和細胞生物學研究的不斷發展,轉染已經成為研究和控制真核細胞基因功能的常規工具。在研究基因功能、調控基因表達、突變分析和蛋白質生產等生物學試驗中,其套用越來越廣泛。

細胞轉染是指將外源分子如DNA,RNA等導入真核細胞的技術。隨著分子生物學和細胞生物學研究的不斷發展,轉染已經成為研究和控制真核細胞基因功能的常規工具。在研究基因...
轉染(transfection)是真核細胞主動或被動導入外源DNA片段而獲得新的表型的過程。從本質上講,和轉化沒有根本的區別。無論是轉染還是轉化,其關鍵因素都是用氯化鈣...
基因轉染技術將特定的遺傳信息傳遞到真核細胞 中,這種技術不但革新了生物學和醫學中許多基本問題的研究,也推動了診斷和治療方面的分子技術 發展,並使基因治療 成為...
轉染作用是DNA小片段插入體細胞或細胞系的過程。若此DNA未與宿主細胞DNA整合而獲表達,稱“瞬時轉染(transient transfection)”;若與宿主細胞DNA整合併隨後者的複製而...
轉染(transfection)指真核細胞由於外源DNA摻入而獲得新的遺傳標誌的過程。DNA轉染技術的發展對現代分子生物學產生了巨大的影響。基因轉染技術不僅是研究轉基因和基因...
真核轉染,一些真核蛋白在原核宿主細胞中的表達不但行之有效而且成本低廉,然而許多在細菌中合成的真核蛋白或因摺疊方式不正確,或因摺疊效率低下,結果使得蛋白活性...
基因轉染是一種“將具生物功能的核酸轉移或運送到細胞內並使核酸在細胞內維持其生物功能”的技術。其中,核酸包括DNA(質粒和線性雙鏈DNA),反義寡核苷酸及RNAi(RNA...
分子轉染是DNA小片段插入體細胞或細胞系的過程。若此DNA未與宿主細胞DNA整合而獲表達,稱“瞬時轉染”;若與宿主細胞DNA整合併隨後者的複製而複製稱“穩定轉染”。...
瞬時轉染(transient transfection)是將DNA導入真核細胞的方式之一。在瞬時轉染中,重組DNA導入感染性強的細胞系以獲得目的基因暫時但高水平的表達。轉染的DNA不必整合...
穩定轉染或持久的轉染是用於建立克隆的細胞系,這種細胞系中轉染的目的基因整合到染色體DNA中並指導適量目的蛋白的合成。...
脂質體轉染定義 編輯 最初,人們只是運用脂質體模擬生物膜,研究膜的構造及功能,從而發現了膜的融合及內吞作用,因而可用作外源物質進入細胞的載體。...
293細胞是人腎上皮細胞系,有多種衍生株,比如HEK293,293T/17等,來源都是人胚胎腎細胞,其極少表達細胞外配體所需的內生受體,且比較容易轉染,是一個很常用的...
表達一個DNA分子上的基因標記的細胞經常也表達另一個DNA分子攜帶的基因標記,這種物理上不相連的基因被整合到同一整合序列並在同一轉染細胞內表達的現象叫做共轉染 ...
表達一個DNA分子上的基因標記的細胞經常也表達另一個DNA分子攜帶的基因標記,這種物理上不相連的基因被整合到同一整合序列並在同一轉染細胞內表達的現象叫做共轉染...
瞬時轉染法是將DNA導入真核細胞的方式之一。在瞬時轉染中,重組DNA導入感染性強的細胞系以獲得目的基因暫時但高水平的表達。轉染的DNA不必整合到宿主染色體,可在比...
原代細胞核酸轉染儀所採用的技術是德國amaxa公司的Nucleofector™ 專利創新技術,其原理是採用獨特的電場參數與細胞類型特異的轉染溶液相結合的方法,直接將DNA轉到細胞...
脂質體轉染法是指陽離子脂質體表面帶正電荷,能與核酸的磷酸根通過靜電作用將DNA分子包裹入內,形成DNA一脂複合體,被表面帶負電荷的細胞膜吸附,再通過膜的融合作用...
中文名稱 RNA轉染 英文名稱 RNA transfection 定義 將RNA分子導入細胞的過程。可用以研究RNA的功能。 套用學科 生物化學與分子生物學(一級學科),方法與技術(二級...
中文名稱 質粒轉染 英文名稱 plasmid transfection 定義 將外源質粒導入真核細胞的過程。 套用學科 生物化學與分子生物學(一級學科),方法與技術(二級學科) 以上...
中文名稱 DNA轉染 英文名稱 DNA transfection 定義 將外源DNA分子導入真核細胞的過程。一般細胞很難接受外源DNA分子,可用適當的化學或物理方法處理(如磷酸鈣法、...
細胞重組(cell reconstruction)是指從活細胞中將細胞器及其組分分離出來,再在體外一定條件下將不同來源的細胞器及其組分重新組合,使之重新裝配成為具有生物活性的細胞...
《細胞生物學技術》是2010年科學出版社出版的圖書,作者是呂冬霞。本書系統地介紹了細胞生物學實驗技術體系,側重對實驗技能的培養,是一本從事生命科學研究的實驗技術...
磷酸鈣轉染技術是由Graham等於1973年首創,實驗室中轉染哺乳動物細胞最廣泛使用的方法。儘管磷酸鈣轉染是一種簡單的基因治療方法,但由於受沉澱條件 (比如pH值、溫度、...
是一種脂質配方,它能夠與要轉染進入哺乳動物細胞的核酸形成複合體.可以為DNA轉染進入懸浮細胞(如在符合化學定義的培養基中的淋巴細胞系)的過程提供出眾的效能 多...
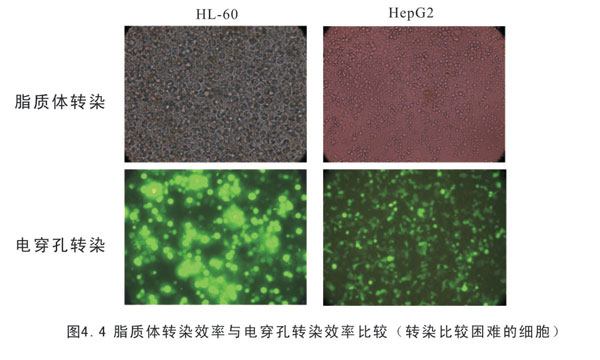
中文名稱 轉染率 英文名稱 transfection efficiency 定義 外源病毒、噬菌體DNA或外源DNA導入細胞的效率。 套用學科 細胞生物學(一級學科),細胞培養與細胞工程(二級...
