基本介紹
- 中文名:競爭吸附
- 外文名:competitive adsorption
- 意義:離子之間相互作用的一種表現形式
- 作用:小分子、離子
- 學科:物理化學
概念
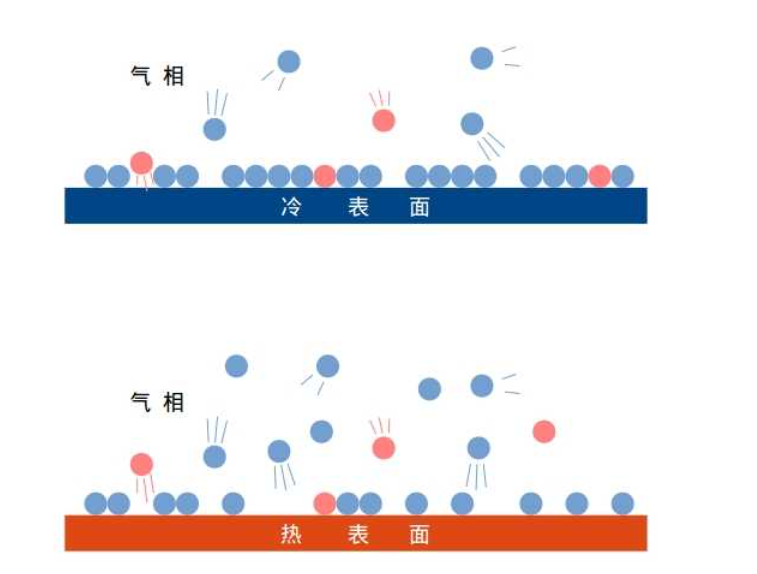 競爭吸附
競爭吸附礦物對金屬離子競爭吸附研究
吸附描述
 競爭吸附
競爭吸附
 競爭吸附
競爭吸附 競爭吸附
競爭吸附競爭吸附是多個組分在吸附劑表面進行吸附時所發生的相互競爭現象。這樣的吸附過程可能是不同組分分別吸附在不同類型的活性中心上,也可能是都吸附在相同類型的活性...
在研究多孔固體的物理吸附時,逐漸增加氣體壓力時得到的吸附等溫線與吸附後逐漸降低壓力時得到的脫附等溫線不相重合的現象被稱為吸附滯後現象。...
吸附等溫式是在溫度固定的條件下,表達吸附量同溶液濃度之間關係的數學式。由於表面吸附,造成在溶液與氣相的交界處存在著一個濃度和性質與兩體相不同的表面薄層,它...
土壤物理化學吸附性又叫離子交換吸附,是土壤的一種吸收性能。指土壤溶液里的離子與土壤細粒表面所吸附的同性電荷離子之間相互交換的物理化學現象。...
《介孔矽材料吸附水中污染物技術與原理》是2015年東南大學出版社出版的圖書,作者是秦慶東。...
注氣後,競爭吸附置換,必然使一部分吸附的煤層氣解吸擴散,從而引起擴散速率、滲流速度和採收率提高。[4] 我國對注氣驅替提高煤層氣採收率進行了較為充分的研究。...
ECBM全稱為Enhanced Coal Bed Methane Recovery,即所謂的提高煤層氣採收率。方法是通過向煤層、廢氣礦井、鹹水層等地方注入CO2使得其裡面的CH4形成競爭吸附,進而把CH4...
1971年瑞典學者Engvall和Perlmann,荷蘭學者Van Weerman和Schuurs分別報導將免疫技術發展為檢測體液中微量物質的固相免疫測定方法,即酶聯免疫吸附測定法 (Enzyme-Linked...
磷解吸,是指吸附狀態的磷重新進入土壤溶液的過程。是吸附過程的逆向反應,在農業生產上具有重要作用。土壤中的吸附態磷並不能全部被重新解吸,故土壤磷的解吸等溫...
35. “酚類化合物在活性碳纖維上的競爭吸附”,梅海,盛國英,傅家謨,符若文,曾漢民,《廣州環境科學》,1998, 13(1), 9-1336.“活性碳纖維的氧化還原特性及套用...
