基本介紹
形成原理,套用,1、配液:,2、操作步驟(方法一):,(3)DNA-磷酸鈣沉澱物的製備:,(4)轉染受體細胞:,3、基因組DNA轉染(方法二):,
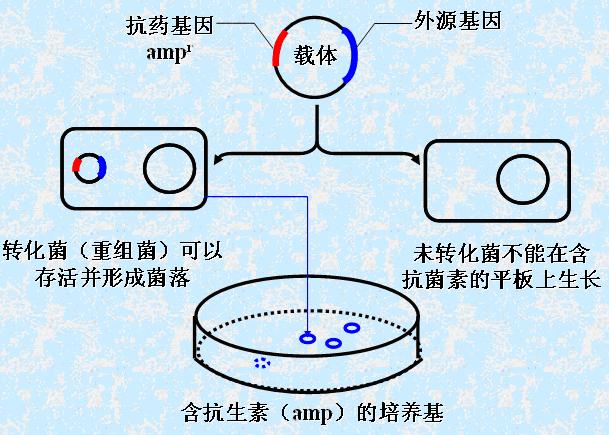
形成原理
核酸以磷酸鈣-DNA共沉澱物的形成出現時,可使DNA黏附在細胞表面,利於細胞吞入攝取,或通過細胞膜脂相收縮時裂開的空隙進入細胞內,進入細胞的DNA僅有1%-5%可以進入細胞核中,其中僅有不到1%的DNA可以與細胞DNA整合,在細胞中進行穩定表達,基因轉導的頻率大約為10,這項技術能用於任何DNA導入哺乳動物細胞進行暫時性表達或長期轉化的研究。
套用
此方法對於貼壁細胞轉染是最常用並首選的方法。
1、配液:
2× HBS1.63gNaCl;1.19g Hepes;0.023gNa2PO4.2H2O;加水至100ml(pH7.1),過濾,<4℃保存。
2mmol/L CaCl2過濾除菌。
TE 0.1mmol/LEDTA;1mmol/LTris-HCl(pH 8.0).
G418(新黴素G418)液1g G418溶於1mmol/L Hepes緩衝液中,加水至10ml,過濾除菌,<4℃保存。
G418選擇性培養基用含10%胎牛血清的DMEM培養基配製,G418濃度為200-800mg/L。
注意對受體細胞先做預實驗,選用在10-14天內能殺死細胞50%以上的最低濃度。
2mmol/L CaCl2過濾除菌。
TE 0.1mmol/LEDTA;1mmol/LTris-HCl(pH 8.0).
G418(新黴素G418)液1g G418溶於1mmol/L Hepes緩衝液中,加水至10ml,過濾除菌,<4℃保存。
G418選擇性培養基用含10%胎牛血清的DMEM培養基配製,G418濃度為200-800mg/L。
注意對受體細胞先做預實驗,選用在10-14天內能殺死細胞50%以上的最低濃度。
2、操作步驟(方法一):
(1)供體DNA製備:按前介紹的DNA提取法提取DNA,溶於TE中,40mg/L。
(2)受體細胞的培養:研究癌基因轉移應選擇不含人類Alu序列的動物細胞系作為受體細胞。如小鼠NIH-3T3細胞系等,該細胞有一定自發轉化傾向,一般在轉染前1天接種細胞,接種密度為2×10個/cm,用含10%胎牛血清的DMEM培養基,37℃、5% CO2培養,待細胞占50%-70%瓶底面積時,用於轉染試驗。
(2)受體細胞的培養:研究癌基因轉移應選擇不含人類Alu序列的動物細胞系作為受體細胞。如小鼠NIH-3T3細胞系等,該細胞有一定自發轉化傾向,一般在轉染前1天接種細胞,接種密度為2×10個/cm,用含10%胎牛血清的DMEM培養基,37℃、5% CO2培養,待細胞占50%-70%瓶底面積時,用於轉染試驗。
(3)DNA-磷酸鈣沉澱物的製備:
將供體細胞DNA和PSV-2neo質粒載體DNA用TE配製成40mg/L的DNA溶液,同時想供體細胞DNA溶液200ul中加入新黴素基因的質粒DNA溶液(20mg/L)220ul和2 x HBS 250ul(PSV2-neo為1-2mg/L)。
取500ul上述DNA溶液加入矽化試管中,緩慢加入3.1ml CaCl2(2mol/L)混勻30s。
然後立即混旋,室溫下靜置30min,待溶液輕度渾濁後,吹打後即用於轉染受體細胞。
取500ul上述DNA溶液加入矽化試管中,緩慢加入3.1ml CaCl2(2mol/L)混勻30s。
然後立即混旋,室溫下靜置30min,待溶液輕度渾濁後,吹打後即用於轉染受體細胞。
(4)轉染受體細胞:
將處於對數生長期已占瓶底50%-70%的受體細胞在轉染前4h更換一次新鮮培養基,每瓶5ml(25ml培養瓶)。
吸取0.5DNA-磷酸鈣沉澱,加入含5ml培養基的細胞瓶中搖勻。
置37℃、5% CO2培養24h或更長,使細胞充分吸入DNA-磷酸鈣結晶顆粒。
更換新鮮培養基,繼續培養24h,誘導轉染基因的表達。
更換濃度為800mg/L的G418選擇培養基進行篩選。同時設有未能轉染的對照細胞。
培養大約3-5天,對照細胞大部分死亡,這時轉染細胞更換濃度為200mg/L的G418選擇培養基,每3-4天更換一次選擇培養基。
2周后對照細胞死亡,在轉染的細胞瓶中可見有抗藥性的細胞克隆出現,待其增大後再進行克隆化和擴大培養。可建立轉化細胞株,並作進一步鑑定。
本實驗要加入PSV-neo、DNA於外源DNA共轉染受體細胞,這樣可使受體細胞獲得新黴素(neo)基因的抗藥性,這樣即使癌基因沒有出現明顯的“轉化灶”,也可測出轉入的外源性基因的抗新黴素的標記。而且還可利用被新黴素基因導入的受體細胞通過G418選擇性培養基篩選轉化的細胞建立細胞株。Uoyi獲取“轉化灶”為目的,可不加入PSV2-neo DNA,只需將從癌細胞中提取的基因組DNA導入受體細胞即可,方法如下。
吸取0.5DNA-磷酸鈣沉澱,加入含5ml培養基的細胞瓶中搖勻。
置37℃、5% CO2培養24h或更長,使細胞充分吸入DNA-磷酸鈣結晶顆粒。
更換新鮮培養基,繼續培養24h,誘導轉染基因的表達。
更換濃度為800mg/L的G418選擇培養基進行篩選。同時設有未能轉染的對照細胞。
培養大約3-5天,對照細胞大部分死亡,這時轉染細胞更換濃度為200mg/L的G418選擇培養基,每3-4天更換一次選擇培養基。
2周后對照細胞死亡,在轉染的細胞瓶中可見有抗藥性的細胞克隆出現,待其增大後再進行克隆化和擴大培養。可建立轉化細胞株,並作進一步鑑定。
本實驗要加入PSV-neo、DNA於外源DNA共轉染受體細胞,這樣可使受體細胞獲得新黴素(neo)基因的抗藥性,這樣即使癌基因沒有出現明顯的“轉化灶”,也可測出轉入的外源性基因的抗新黴素的標記。而且還可利用被新黴素基因導入的受體細胞通過G418選擇性培養基篩選轉化的細胞建立細胞株。Uoyi獲取“轉化灶”為目的,可不加入PSV2-neo DNA,只需將從癌細胞中提取的基因組DNA導入受體細胞即可,方法如下。
3、基因組DNA轉染(方法二):
配製磷酸轉染。NaCl 8.0g,Hepes5.0g;Na2HPO40.099g;加溫水至1000ml。用時現配,pH很重要,一定要控制在6.95±0.65,消毒滅菌,-20℃貯存備用。
按前面介紹的方法提取癌細胞基因組DNA。
取供體基因DNA50-100ug,加3mmol/L NaCl或醋酸鈉,使最終濃度至0.3mmol/L,混勻。
再加2倍體積無水乙醇3000r/min離心10min,棄上清。
加入轉染緩衝液,待DNA充分融解後,夾在如2.5mmol/L CaCl2,終濃度為125mmol/L,用吸管吹打3次,置室溫下10-30min,待液體透明度降低,出現微濁藍色時,即可用於轉染細胞。
取生長狀態良好處於半匯合階段的對數生長期細胞,在轉染前4h,更新培養基一次。
轉染。向每瓶中加DNA-磷酸鈣沉澱物0.5-1ml,置37℃作用4-6h。
培養。棄去培養基,用15%甘油處理3min,無血清培養基漂洗1次,接近匯合時血清用量降至5%,培養2-3周。
檢測。逐日觀察,待出現“轉化灶”後,克隆分離,擴大培養建立轉化細胞株。
按前面介紹的方法提取癌細胞基因組DNA。
取供體基因DNA50-100ug,加3mmol/L NaCl或醋酸鈉,使最終濃度至0.3mmol/L,混勻。
再加2倍體積無水乙醇3000r/min離心10min,棄上清。
加入轉染緩衝液,待DNA充分融解後,夾在如2.5mmol/L CaCl2,終濃度為125mmol/L,用吸管吹打3次,置室溫下10-30min,待液體透明度降低,出現微濁藍色時,即可用於轉染細胞。
取生長狀態良好處於半匯合階段的對數生長期細胞,在轉染前4h,更新培養基一次。
轉染。向每瓶中加DNA-磷酸鈣沉澱物0.5-1ml,置37℃作用4-6h。
培養。棄去培養基,用15%甘油處理3min,無血清培養基漂洗1次,接近匯合時血清用量降至5%,培養2-3周。
檢測。逐日觀察,待出現“轉化灶”後,克隆分離,擴大培養建立轉化細胞株。