碳酸亞銅(英文名稱cuprous carbonate)為一價金屬銅的碳酸鹽,分子式為Cu2CO3。
碳酸亞銅是一種黃色的固體,密度為4.4g/cm3,具有銅鹽的一般毒性,高溫不穩定,加熱易分解。自然界不存在礦物體,為人工合成的亞銅鹽。其性能不存在燃燒、爆炸、自聚等危險。能溶於鹼、氨水,不能溶於水。主要用途是作為製造其他亞銅鹽的原料。
基本介紹
- 中文名:碳酸亞銅
- 外文名:cuprous carbonate
- 性質:黃色固體
- 密度:4.40g/cm3
- 分子式:Cu2CO3
亞銅化合物形成和存在條件,製取方法,碳酸亞銅的用途,
亞銅化合物形成和存在條件
金屬銅原子序數是29,屬於周期表中ⅠB族,銅在金屬活潑順序表中處於賤金屬和貴金屬之間,表明其存在多種價態的化合物。銅常見的氧化態為+2及+1,這表明銅在與其他離子有較強的相互作用的環境下,如在離子較強的晶體或溶劑化強的溶液中+2為較穩定的價態。而在共價性很強的晶體中及一些非水溶劑中(如乙腈中),以及氣態下,則+1價要比+2價穩定。Cu及Cu存在許多穩定的化合物,除碳酸銅和碳酸亞銅外,如硫酸銅和硫酸亞酮、氯化銅和氯化亞通、氧化銅和氧化亞銅、溴化銅和溴化亞酮等。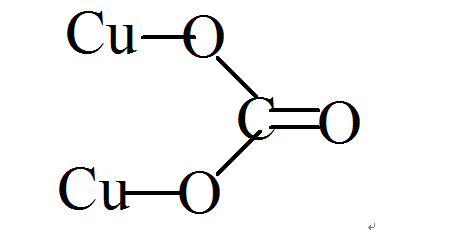 結構式
結構式
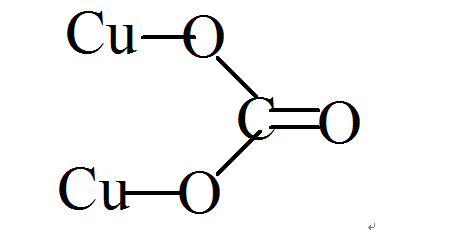 結構式
結構式製取方法
2CuCl + Na2CO3→ Cu2CO3 + 2NaCl
碳酸亞酮在常溫下比較穩定,但在高溫下就要分解成氧化亞銅和二氧化碳,如果氧存在則氧化亞酮與氧繼續反應生成氧化銅。
銅化合物都是有毒的化學品,雖然人體需要少量的銅鹽但過量的攝入會引起嘔吐、噁心、反胃、麻木、貧血、甚至昏迷和死亡。有關碳酸亞銅毒性未見記錄,可參照一般銅鹽的最小致死量MLD為100mg/kg。長期接觸通含銅化合物粉塵會刺激口、鼻、眼、上呼吸道黏膜、引起皮炎、皮膚過敏等反應。此外銅鹽對低等生物有很強的毒性,地面水限制銅含量為0.1mg/L。
碳酸亞銅的用途
碳酸亞銅是製取一些亞銅化合物的原料,此外可以和碳酸銅等組成石油鑽井液中脫硫化氫的除硫劑及緩蝕劑,生成不活潑的硫化銅和硫化亞銅沉澱,用於石油鑽井操作,還可以與氨水等構成脫CO劑。
